А). Внести в пробирку по 1-2 капли сульфата меди (II) и иодида калия.
- Отметить изменения в пробирке.
- Написать уравнение реакции сульфата меди (II) с иодидом калия, учитывая, что образуются иодид меди (I) и йод:
СuSO4 + KI →
Для определения цвета выпавшего осадка иодида меди (I) необходимо свободный йод, маскирующий своей окраской цвет осадка, перевести в бесцветный ион.
Для этого прибавить в пробирку несколько капель раствора тиосульфата натрия до исчезновения бурой окраски.
- Взаимодействие йода с тиосульфатом натрия протекает в соответствии с уравнением:
2Na2S2O3 + I2 → 2NaI + Na2S4O6
Цвет иодида меди (I)………….
К осадку иодида меди (I) прибавить несколько капель раствора тиосульфата натрия до растворения осадка вследствие образования хорошо растворимого комплексного соединения меди (I), Na3[Cu(S2O3)2].
- Составить уравнение реакции:
CuI + Na2S2O3 → Na3[Cu(S2O3)2] + NaI
б). В пробирку внести 1-2 капли раствора соли меди (II) и 1-2 капли раствора тиосульфата натрия - Na2S2О3. Обесцвечивание раствора обусловлено превращением ионов меди (II) в тиосульфат меди (I):
2 Cu2+ + 3S2O32- ® Cu2S2O3 + S4O62-
Раствор прокипятить, отметить цвет осадка сульфида меди (I), образующегося при кипячении по реакции
Cu2S2O3 + H2O ® Cu2S¯ + SO42- + 2H+.
Реакция может быть использована для отделения ионов Cu2+ от ионов Cd2+.
- вывод
Лабораторная работа № 8, 9
на тему: «Химические свойства металлов VIIIБ – подгруппы и их соединений.
Железо, кобальт, никель»
Цель работы:
- Изучить свойства металлов VIIIБ – подгруппы;
- Изучить свойства характеристичных соединений металлов VIIIБ – подгруппы.
Краткая теория.
1. Положение элементов в периодической системе, свойства атомов
Электронные конфигурации атомов, валентные электроны металлов VIIIБ- подгруппы:
Степени окисления металлов VIIIБ - подгруппы …………..……..…….
2. Свойства простых веществ – металлов:
- положение в «ряду стандартных окислительно-восстановительных (электродных) потенциалов металлов»
φ(Men+/Me) =
- активность металлов:
- пассивирование металлов……..
Составьте уравнения реакций:
- взаимодействие с кислородом:
а) Fe б) Co
- взаимодействие с галогенами (хлором):
а) Fe б) Ni
- взаимодействие с серой:
а) Fe б) Co
- взаимодействие с водой термодинамически невозможно для металлов………..
- взаимодействие с водой для металла………….. термодинамически возможно, в воде …………………….
- взаимодействие с водными растворами кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими):
а) Fe + HBr → б) Co + H2SO4(разб) →
б) Fe + H2SO4(разб) → б) Ni + H2SO4(разб) →
- взаимодействие с концентрированной H2SO4:
а) Ni + H2SO4(конц) → ………….+ SO2 + H2O
б) Co + H2SO4(конц) → ………….+ S + H2O
- взаимодействие с разбавленной и концентрированной HNO3:
а) Co + HNO3(разб) → ………….+ N2O + H2O
б) Ni + HNO3(конц) → ………….+ NO2 + H2O
3. Свойства оксидов и гидроксисоединений металлов VIIIБ - подгруппы:
- формулы оксидов металлов VIIIБ - подгруппы ……………………………………….
- формулы гидроксидов металлов VIIIБ - подгруппы ……………………………
- растворимость, взаимодействие с водой оксидов и гидроксидов металлов VIIIБ – подгруппы……
- диссоциация в водном растворе гидроксида железа(II):
Основные свойства проявляют оксид и гидроксид железа ………….
При сплавлении амфотерные свойства проявляют оксид и гидроксид железа ………….
- взаимодействие оксидов и гидроксидов металлов VIIIБ - подгруппы с кислотами и кислотными оксидами.
а) Fe2O3 + H2SO4 →
б) Fe(OH)2 + H2SO4 →
в) Ni(OH)2 + H2SO4 →
- взаимодействие оксида и гидроксида железа (III) с основаниями при сплавлении происходит с образованием простых солей (назовите их) и воды
Fe2O3 + NaOH → ….. + H2O
4. Растворимость солей, гидролиз солей
Плохо растворимы соли железа(II)……………………….. железа (III)…………….,
кобальта(II) …………………………, никеля(II)…………………………………
Растворимые сульфат железа(II) и сульфат железа(III)подвергается гидролизу по …………….., среда в растворе …………………….
5. Окислительно-восстановительные свойства соединений металлов VIIIБ - подгруппы
- Используя значения ОВП, приведенных на диаграмме Латимера, охарактеризовать окислительно-восстановительные свойства соединений железа.
Укажите соединения, проявляющие
а) только окислительные свойства………
б) только восстановительные свойства…….
в) двойственные окислительно-восстановительные свойства…….
г) в ряду Fe2+ Co2+ Ni2+ восстановительные свойства ионов Me2+………………...
д) в ряду Fe3+ Co3+ Ni3+ окислительные свойства ионов Me3+………………...
Диаграмма Латимера для триады Fe - Co – Ni:
+2,20 +0,771 - 0,4402
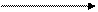
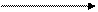
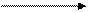 FeO42- Fe3+ Fe2+ Fe
FeO42- Fe3+ Fe2+ Fe
 +0,36 -1,5
+0,36 -1,5

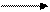 [Fe(CN)6]3- [Fe(CN)6]4-
[Fe(CN)6]3- [Fe(CN)6]4-
+1,808 -0,277
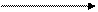
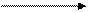 Co3+ Co2+ Co
Co3+ Co2+ Co
 + 0,178
+ 0,178
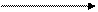
 [Co(NH3)6]3+ [Co (NH3)6]2+
[Co(NH3)6]3+ [Co (NH3)6]2+
+2,25 -0,250

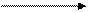
 NiO(OH) Ni2+ Ni
NiO(OH) Ni2+ Ni
-0,49
 [Ni(NH3)6]3+
[Ni(NH3)6]3+
Окислительные свойства соединений………………более выражены в …………………. среде
Восстановительные свойства соединений……………более выражены в …………………. Среде.
В присутствии аммиака восстановительные свойства металлов Co и Ni………………..
6. Комплексные соединения металлов VIIIБ - подгруппы
Катионы металлов VIIIБ - подгруппы образуют устойчивые комплексные соединения с аммиаком, цианид- и другими ионами. Поэтому оксиды, гидроксиды кобальта и никеля растворяются, например, в избытке аммиака.
CoO + 6 NH4OH → [Co(NH3)6](OH)2 + 5H2O
гидроксид гекса аминкобальта(II)
Ni(OH)2 + 6 NH4OH → [Ni(NH3)6](OH)2 + 6H2O
гидроксид гекса аминникеля(II)
Дата добавления: 2016-09-20; просмотров: 4343;
