Б) Получение аммиакатных комплексов кобальта
В две пробирки внести по 2 - 3 капли раствора соли кобальта (II) и прибавить по каплям концентрированный раствор аммиака до выпадения осадка гидроксида кобальта (II) и его дальнейшего растворения вследствие образования комплексного соединения. Одну из пробирок несколько раз встряхнуть до изменения окраски от зеленоватой до желто-коричневой. Во вторую пробирку добавить 2 - 3 капли 3%-ного раствора пероксида водорода.
- Отметить, какие изменения происходят в пробирках
- Составить уравнение реакции образования осадка гидроксида кобальта (II) при действии недостатка аммиака:
CoCl2 + NH4OH ®
- Составить уравнение реакции растворения осадка гидроксида кобальта (II) при действии избытка аммиака и образования аммиакатного комплекса кобальта (II):
Co(OH)2 + 6NH4OH ® [Co(NH3)6](OH)2 + 6H2O
- Составить уравнение реакции окисления полученного комплексного соединения кобальта (II) в комплексное соединение кобальта (III) кислородом воздуха:
[Co(NH3)6](OH)2 + O2 + H2O ® [Co(NH3)6](OH)3
- Составить уравнение реакции окисления полученного комплексного соединения кобальта (II) пероксидом водорода с образованием аммиакатного комплекса кобальта (III):
[Co(NH3)6](OH)2 + H2O2 ® [Co(NH3)6](OH)3
- Используя данные диаграммы Латимера, объясните, почему аммиакатный комплексный ион Со(II) окисляется кислородом воздуха, тогда как аквакомплекс Со(II) - [Со(Н2О)6]2+ - удается окислить лишь пероксидом водорода
- Составить уравнения диссоциации полученных комплексных соединений:
[Co(NH3)6](OH)2 ®
[Co(NH3)6](OH)3 ®
- диссоциации комплексных ионов и выражения констант их нестойкости
[Co(NH3)6]2+ 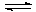 K нест [Co(NH3)6]2+ =
K нест [Co(NH3)6]2+ =
[Co(NH3)6]3+ 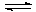 K нест [Co(NH3)6]3+ =
K нест [Co(NH3)6]3+ =
- Укажите по величине константы нестойкости, какой комплексный ион прочнее:
K нест [Co(NH3)6]2+ = K нест [Co(NH3)6]3+ =
- сравните координационные формулы комплексных соединений кобальта в разных степенях окисления, и укажите их пространственную конфигурацию:
[Co(NH3)6]2+ [Co(NH3)6]3+
Дата добавления: 2016-09-20; просмотров: 6226;
