В) Получение аммиакатного комплекса никеля(II)
Один микрошпатель соли никеля (II) растворить в 5 каплях воды. Добавить несколько капель раствора аммиака до растворения осадка в результате образования аммиакатного комплекса. Добавить к раствору 2 - 3 капли раствора сульфида аммония.
- Отметить, какие изменения происходят в пробирке
- В осадок выпадает…………….
- Составить уравнение реакции образования осадка гидроксида никеля (II) при действии недостатка аммиака:
NiCl2 + NH4OH ®
- Составить уравнение реакции растворения осадка гидроксида никеля (II) при действии избытка аммиака и образования аммиакатного комплекса никеля (II):
Ni(OH)2 + 6NH4OH ® [Ni(NH3)6](OH)2 + 6H2O
- Составить уравнение диссоциации полученного комплексного соединения:
[Ni(NH3)6](OH)2 ®
- Составить уравнение диссоциации комплексного иона и выражение для константы нестойкости
[Ni(NH3)6]2+  K нест [Ni(NH3)6]2+ =
K нест [Ni(NH3)6]2+ =
- Составить молекулярное и ионное уравнения реакции взаимодействия полученного комплексного соединения никеля с сульфидом аммония:
[Ni(NH3)6](OH)2 + (NH4)2S ®
[Ni(NH3)6]2+ + S2- ®
- Рассчитайте константу равновесия по величине константы нестойкости комплексного иона и произведения растворимости сульфида никеля(II), определите направление протекания реакции.
Кравн = Кнест[Ni(NH3)6]2+ / ПРNiS = 10-8,31 / 9,3 10-22
Вывод
Лабораторная работа №10
на тему: «Химические свойства хрома и его соединений.
Химические свойства марганца и его соединений»
Цель работы:
- Изучить свойства металлов VIБ – подгруппы;
- Изучить свойства характеристичных соединений металлов VIБ – подгруппы.
Краткая теория.
1. Положение элементов в периодической системе, свойства атомов
Электронные конфигурации атомов, валентные электроны металлов VIБ- подгруппы:
Степени окисления: VIБ - подгруппа …………..……..…….
2. Свойства простых веществ – металлов:
- положение в «ряду стандартных окислительно-восстановительных (электродных) потенциалов металлов»
φ(Men+/Me) =
- активность металлов:
- пассивирование металлов……..
Составьте уравнения реакций:
- взаимодействие с кислородом:
а) Cr б) Mo
- взаимодействие с галогенами (хлором):
а) Cr б) Mo
- взаимодействие с серой:
а) Cr б) Mo
- взаимодействие с водой термодинамически невозможно для металла…………..
- взаимодействие с водой для металла………….. термодинамически возможно, однако он устойчив в воде так как…………………….
- взаимодействие с водными растворами кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими):
а) Cr + HBr →
б) Cr + H2SO4(разб) →
- взаимодействие с концентрированной H2SO4:
а) Cr + H2SO4(конц) → ………….+ S + H2O
б) Mo + H2SO4(конц) → ………….+ H2S + H2O
- взаимодействие с разбавленной и концентрированной HNO3:
а) Cr + HNO3(разб) → ………….+ N2O + H2O
б) Cr + HNO3(конц) → ………….+ NO2 + H2O
3. Свойства оксидов и гидроксисоединений металлов VIБ - подгруппы:
- формулы оксидов металлов VIБ - подгруппы ……………………………………….
- формулы гидроксисоединений металлов VIБ - подгруппы ……………………………
- растворимость, взаимодействие с водой оксидов и гидроксисоединений металлов VIБ - подгруппы
- диссоциация в водном растворе гидроксида хрома(III):
[Cr(OH)4]- + H+  H2O + Cr(OH)3
H2O + Cr(OH)3  Cr3+ + 3OH-
Cr3+ + 3OH-
- диссоциация в водном растворе хромовой кислоты:
1 стадия К1 =
2 стадия К2 =
Основные свойства проявляют оксид и гидроксид хрома………….
Амфотерные свойства проявляют оксид и гидроксид хрома………….
Кислотные свойства проявляют соединения хрома:………….
- взаимодействие оксидов и гидроксидов металлов VIБ - подгруппы с кислотами и кислотными оксидами.
а) Cr2O3 + H2SO4 →
б) Cr(OH)3 + H2SO4 →
- взаимодействие оксидов и гидроксидов металлов VIБ - подгрупп с основаниями при сплавлении происходит с образованием простых солей (назовите их) и воды
Cr2O3 + NaOH → NaCrO2 + H2O
Cr(OH)3 + NaOH → NaCrO2 + H2O
CrO3 + NaOH → Na2CrO4 + H2O
H2CrO4 + NaOH → Na2CrO4 + H2O
- взаимодействие оксида и гидроксида хрома(III) с водными растворами щелочей происходит с образованием комплексных солей (назовите их):
Cr2O3 + NaOH + H2O → Na[Cr(OH)4]
Cr(OH)3 + NaOH → Na[Cr(OH)4]
4. Растворимость солей, гидролиз солей
Плохо растворимы соли хрома(III)………….
Плохо растворимы соли хроматы:………….
Растворимый сульфат хрома(III) подвергается гидролизу по …………….., среда в растворе …………………….
Гидролиз хлорида хрома (III) усиливается при добавлении:
а) NaOH б) HCl в) Mg г) при нагревании
Растворимый хромит натрия……………… и хромат натрия ……………… подвергаются гидролизу по …………….., среда в растворах …………………….
Получение Cr2S3 и Cr2(CO3)3 обменными реакциями в водном растворе ………………….., так как протекает …………………………
5. Окислительно-восстановительные свойства соединений металлов VIБ - подгруппы
Диаграмма Латимера для хрома:
+ 0,293
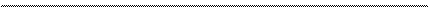
+1,33 - 0,406 - 0,913


 Cr2O72- Cr3+ Cr2+ Cr0 (кислая среда)
Cr2O72- Cr3+ Cr2+ Cr0 (кислая среда)
- 0,744

- 0,165 - 1,057 - 1,35

 CrO42- [Cr(OH)4]-1 Cr(OH)2 (щелочная среда)
CrO42- [Cr(OH)4]-1 Cr(OH)2 (щелочная среда)
- Используя значения ОВП, приведенных на диаграмме Латимера, охарактеризовать окислительно-восстановительные свойства соединений хрома.
Укажите соединения, проявляющие
а) только окислительные свойства………
б) только восстановительные свойства…….
в) двойственные окислительно-восстановительные свойства…….
Окислительные свойства соединений………………более выражены в …………………. среде
Восстановительные свойства соединений……………более выражены в …………………. среде
Дата добавления: 2016-09-20; просмотров: 5523;
