Опыт 7. Получение и свойства гидроксида никеля (II)
В четыре пробирки поместить по 2-3 капли раствора соли никеля(II) и добавить по каплям раствор гидроксида натрия до выпадения осадка гидроксида никеля(II). В первую пробирку внести несколько капель 2 н раствора соляной кислоты, во второй пробирке осадок тщательно размешать стеклянной палочкой, в третью - добавить 2-3 капли 3% - ного раствора пероксида водорода. В четвертую пробирку прибавить одну каплю бромной воды (сохранить для опыта 12).
– охарактеризовать внешний вид осадка……..
- составить уравнения реакции образования гидроксида никеля(II) в молекулярной и ионной форме
NiSO4 + NaOH → …
- отметить, с каким раствором - соляной кислоты или гидроксида натрия - взаимодействует гидроксид никеля (II)………….
- составить уравнение реакции гидроксида никеля (II) с соляной кислотой в молекулярной и ионной форме
Ni(OH)2 + HCl → …
- отметить, изменяется ли внешний вид осадка Ni(OH)2 во второй пробирке при хранении на воздухе ……………
- отметить, изменяется ли внешний вид осадка Ni(OH)2 во второй пробирке с перекисью водорода ……………
- быстрое окисление гидроксида никеля (II) наблюдается в пробирке ……………..
- Написать уравнение реакции окисления гидроксида никеля (II) бромной водой до гидроксида никеля (III).
Ni(OH)2 + Br2 ®
- Указать окислитель…………., восстановитель…………………..;
- Сравнить полученные результаты с результатами опытов по окислению гидроксида железа (II) и гидроксида кобальта (II)
- Сравнить значения стандартных окислительно-восстановительных потенциалов
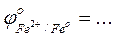
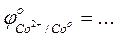
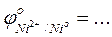
-Указать какой ион - Ni2+, Co2+, или Fe2+ - является более сильным восстановителем …….
-Указать, какой ион - Ni3+, Co3+, или Fe3+ - является более сильным окислителем …….
- сделать вывод о свойствах гидроксида никеля (II)
Дата добавления: 2016-09-20; просмотров: 2497;
