Опыт 6. Получение оксида серы (IV) и его взаимодействие с водой (показательный)
В пробирку внести сульфит натрия Na2SO3 . Добавить 5-6 капель конц. Раствора серной кислоты, закрыть пробирку газоотводной трубкой и пропустить выделяющийся газ в пробирку с водой (к воде предварительно добавить раствор метилового оранжевого). Написать уравнения реакций получения оксида серы (IV) и его взаимодействия с водой.
Опыт 7. Получение и свойства кислой соли – гидрокарбоната кальция
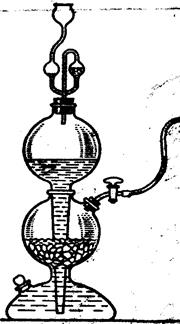 Налить в пробирку раствор гидроксида кальция. Пропустить диоксид углерода из аппарата Киппа (рис.4), полностью погрузив конец отводной трубки в пробирку с раствором гидроксида кальция. Наблюдать вначале образование осадка средней соли, а затем его растворение вследствие образования кислой соли. К полученному раствору гидрокарбоната кальция прилить раствор гидроксида кальция.
Налить в пробирку раствор гидроксида кальция. Пропустить диоксид углерода из аппарата Киппа (рис.4), полностью погрузив конец отводной трубки в пробирку с раствором гидроксида кальция. Наблюдать вначале образование осадка средней соли, а затем его растворение вследствие образования кислой соли. К полученному раствору гидрокарбоната кальция прилить раствор гидроксида кальция.
- Объяснить принцип работы аппарата Киппа
- составить молекулярное и ионное уравнение реакции, протекающей в аппарате Киппа:
CaCO3↓ + HCl → …
- выделяющийся диоксид углерода при взаимодействии с гидроксидом кальция проявляет……………….свойства
- составить уравнение реакции
Ca(OH)2 + CO2 → ... + …
осадок
- составить молекулярное уравнение реакции, протекающей между осадком карбоната кальция и избытком диоксида углерода:
CaCO3↓ + H2O + CO2 → …
- из полученных солей к классу «средних» относится…………...и к Рис. 4. Аппарат Киппа классу «кислых солей»…………….
- «кислые» соли …………растворяются в воде………………..чем «средние» ………………
- составить молекулярное и ионное уравнение реакции взаимодействия гидрокарбоната кальция с гидроксидом кальция
Ca(HCO3)2 +Ca(OH)2→…
- в этом взаимодействии кислая соль - гидрокарбонат кальция – проявляет…………….свойства.
Вывод:
Лабораторная работа №6
на тему: «Химические свойства металлов IIIA и IVA – подгрупп
(Al, Sn, Pb)»
Цель работы:
- Изучить свойства металлов IIIA и IVA- подгрупп;
- Изучить свойства характеристичных соединений металлов IIIA и IVA- подгрупп;
Краткая теория.
1. Положение элементов в периодической системе, свойства атомов
Электронные конфигурации атомов, валентные электроны
IIIA- подгруппа:
IVA- подгруппа:
Степени окисления: IIIA- подгруппа ……………..IVA- подгруппа …….
2. Свойства простых веществ – металлов:
- положение в «ряду стандартных окислительно-восстановительных (электродных) потенциалов металлов»
φ(Men+/Me) =
- активность металлов:
Составьте уравнения реакций:
- взаимодействие с кислородом:
а) Al б) Sn
в) Pb
- взаимодействие с галогенами (хлором):
а) Al б) Sn в) Pb
- взаимодействие с серой:
а) Al
- взаимодействие с водными растворами кислот, окисляющими H+ (HF, HCl, HBr, HI, разбавленной H2SO4, H3PO4, RCOOH и другими):
а) Al + HBr → б) Sn + RCOOH →
- Металлы IIIA – подгруппы не взаимодействует с водой, так как …………………………………, но легко вытесняют водород из водного раствора щелочи
Al + NaOH + H2O →
- взаимодействие с концентрированной H2SO4:
а) Sn + H2SO4(конц) → ………….+ S + H2O
- взаимодействие с разбавленной и концентрированной HNO3:
а) Pb + HNO3(разб) → ………….+ NО + H2O
б) Sn + HNO3(конц) → H2SnO3 + NO2 + H2O
3. Свойства оксидов и гидроксидов металлов IIIA и IVA- подгрупп:
- формулы оксидов металлов IIIA …………и IVA- подгрупп……………….
- формулы гидроксидов металлов IIIA ……………..и IVA- подгрупп……………
- растворимость, взаимодействие с водой оксидов и гидроксидов металлов IIIA и IVA- подгрупп
- диссоциация в водном растворе гидроксидов металлов IIIA и IVA- подгрупп (на примере гидроксида олова (II)):
[Sn(OH)4]2- + 2H+  2 H2O + Sn(OH)2
2 H2O + Sn(OH)2  Sn2+ + 2OH-
Sn2+ + 2OH-
Оксиды и гидроксиды металлов IIIA и IVA- подгрупп проявляют ………………………… свойства
- взаимодействие оксидов и гидроксидов металлов IIIA и IVA- подгрупп с кислотами и кислотными оксидами.
а) Al2О3 + H2SO4 →
б) Pb(OH)2 + H2SO4 →
- взаимодействие оксидов и гидроксидов металлов IIIA и IVA- подгрупп с основаниями при сплавлении происходит с образованием простых солей и воды
PbO + NaOH → Na2PbO2 + H2O
Pb(OH)2 + NaOH → Na2PbO2 + H2O
- взаимодействие оксидов и гидроксидов металлов IIIA и IVA- подгрупп с водными растворами щелочей происходит с образованием комплексных солей
Al2О3 + NaOH + H2O → Na[Al(OH)4]
Al(OH)3 + NaOH → Na[Al(OH)4]
Pb(OH)2 + NaOH →
4. Окислительно-восстановительные свойства соединений металлов IIIA и IVA-подгрупп
Соединения алюминия ……………….окислительно-восстановительных свойств, так как …………
Используя значения ОВП, приведенных на диаграммах Латимера, охарактеризовать окислительно-восстановительные свойства соединений олова.
Диаграммы Латимера:
А) для олова;
-0,118
 SnO2
SnO2
+0,154 -0,141

 Sn4+ Sn2+ Sn0
Sn4+ Sn2+ Sn0
 -0,96 -0,79
-0,96 -0,79

 [Sn(OH)6]2- [Sn(OH)6]4-
[Sn(OH)6]2- [Sn(OH)6]4-
Используя значения ОВП, приведенных на диаграммах Латимера, охарактеризовать окислительно-восстановительные свойства соединений свинца.
Диаграммы Латимера:
б) для свинца:-0,956

 PbS
PbS
1,685 -0,356

 PbSO4
PbSO4
1,456 - 0,126

 PbO2 Pb2+ Pb0
PbO2 Pb2+ Pb0
 0,305 -0,538
0,305 -0,538
 [Pb(ОН)6]2- [Pb(OH)4]2-
[Pb(ОН)6]2- [Pb(OH)4]2-
ВНИМАНИЕ! Все соединения свинца ядовиты! При работе с ними соблюдать особую осторожность! По окончании опытов с кислотами растворы слить в слив, а не растворившиеся металлы положить в специальную посуду!
Опыт 1. Взаимодействие «амальгамированного» алюминия с водой
В пробирку с 5 мл дистиллированной воды поместить обычную алюминиевую проволоку и оставить для сравнения до окончания опыта. В две пробирки налить по 3-5 мл раствора соли ртути(II) и опустить в каждую металлическую алюминиевую проволоку, выдержать в течение 5 минут. После чего проволочки протереть кусочком фильтровальной бумаги, и одну из них оставить на воздухе, а вторую поместить в пробирку с дистиллированной водой. Наблюдать за изменениями в пробирках и на поверхности проволоки, оставшейся на воздухе, в течение 5-10 минут.
- Отметить, происходят ли изменения в с обычной алюминиевой проволокой в воде
- в обычных условиях алюминий не взаимодействует с водой, потому что…………………
- отметить, как изменилась поверхность алюминиевой проволоки после обработки солью ртути………..
- составить уравнения реакций, протекающих в растворе соли ртути
Hg(NO3)2 + H2O →
- составить уравнения реакций, протекающих в растворе соли ртути на поверхности алюминиевой проволоки:
Al2O3 + HNO3 →
Al + Hg(NO3)2 →
- объяснить, может ли образоваться на поверхности «амальгамированного» алюминия защитная оксидная пленка……….
- отметить, что образуется на поверхности «амальгамированного» алюминия на воздухе…..
- составить уравнение реакции окисления алюминия на воздухе:
Al + O2 →
- отметить, какие изменения происходят в пробирке с «амальгамированной» алюминиевой проволокой в воде
- составить уравнение реакции между «амальгамированным» алюминием и водой:
Al + H2O →
- ответить, пассивирован ли «амальгамированный» алюминий.
Дата добавления: 2016-09-20; просмотров: 2444;
