А – обобщенная схема хроматографа; б – хорошо разрешенная хроматограмма четырехкомпонентной смеси
На рис. 4.2, б в качестве примера представлена хроматограмма, содержащая информацию о разделяемой биопробе. Число пиков соответствует исходному количеству компонентов; а по оси абсцисс отложены величины времени «удерживания» каждого конкретного компонента внутри колонки, т. е. времени его эффективного выделения из общей смеси (t1 — время удерживания для вещества, сорбирующегося наименее прочно).
Эффективность разделения пропорциональна длине колонки, но при увеличении ее длины происходит размывание зоны каждого компонента и, следовательно, расширение пиков (ширина пика пропорциональна времени нахождения вещества в колонке), поэтому длину колонки необходимо ограничивать.
Описанный процесс отражает только самые общие черты хроматографического процесса, каждый вариант ХрГ имеет свои аппаратурные особенности, использует иные материалы для НФ и ПФ и требует различный режимов разделения. Поэтому для более детального ознакомления рассмотрим основные хроматографические методы по отдельности.
АДСОРБЦИОННАЯ ХРОМАТОГРАФИЯ
Адсорбционная хроматография основана на различной степени адсорбции компонентов исследуемой пробы на пористом адсорбенте. В зависимости от агрегатного состояния ПФ различают твердожидкостную адсорбционную ТЖАд или газоадсорбционную(Гад) ХрГ.
Пористые материалы обладают способностью достаточно прочно сорбировать различные вещества. В твердожидкостном варианте на границе твердой и жидкой фаз частицы твердого адсорбента обтекаются ПФ, несущей в растворенном виде анализируемую биопробу. Ее разделение происходит за счет того, что компоненты с различной прочностью удерживаются на поверхности адсорбента. При выполнении газоадсорбционного варианта растворитель заменяется на газ-носитель, который переносит по колонке газообразную смесь компонентов биопробы.
В качестве НФ в адсорбционной хроматографии используются несколько видов материалов.
Силикагелъ. Этот материал получают из золей кремневой кислоты, при этом в зависимости от условий проведения реакции образуются нерегулярные или сферические частицы различной величины и пористости. Хроматографию при нормальном давлении обычно проводят на сорбентах с размерами частиц 40...60 мкм, при высоком давлении — на сорбентах с размерами 3, 5, 7, 10 мкм. Важной характеристикой сорбента наряду с размерами частиц является средний диаметр их пор.
Силикагели применяются:
— для фракционирования неполярных и малополярных веществ;
— контроля качества разделения (главным образом, при высоком давлении на колонках с размером частиц 3... 15 мкм);
— препаративного фракционирования при нормальном дав-лении на сорбентах с размерами частиц 10...30 мкм;
— препаративного разделения в производственном масштабе на сорбентах с диаметрами частиц 60...200 и 200...500 мкм.
Оксид алюминия. Этот адсорбент характеризуется не только размерами частиц, но и кислотно-оcновными свойствами: водная суспензия адсорбента может иметь кислую, нейтральную или основную реакцию. Кроме того, адсорбент может обладать различной степенью активности.
Оксид алюминия применяют для решения тех же задач, что и силикагель: на кислом оксиде алюминия разделяют вещества с кислотными свойствами (фенолы, карбоновые кислоты). На основном оксиде алюминия фракционируют основания (амины), а также удаляют перекиси, присутствующие в органических растворителях (эфире, диоксане и др.).
Поверхностно-модифицированный силикагель. К находящимся на поверхности частиц диоксида кремния атомам 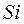 могут быть прикреплены различные группы (например, посредством ковалентной связи), полностью покрывающие поверхность силикагеля, вследствие чего полярный сорбент приобретает гидрофобные свойства. Наиболее прочная адсорбция неполярных и умеренно полярных соединений наблюдается в водной среде. Десорбция происходит в присутствии органических растворителей. Поверхностно-модифицированные силикагели применяют, в основном, в хроматографии с обращенными фазами для аналитического и полупрепаративного разделения, главным образом, полярных веществ.
могут быть прикреплены различные группы (например, посредством ковалентной связи), полностью покрывающие поверхность силикагеля, вследствие чего полярный сорбент приобретает гидрофобные свойства. Наиболее прочная адсорбция неполярных и умеренно полярных соединений наблюдается в водной среде. Десорбция происходит в присутствии органических растворителей. Поверхностно-модифицированные силикагели применяют, в основном, в хроматографии с обращенными фазами для аналитического и полупрепаративного разделения, главным образом, полярных веществ.
КОЛОНОЧНАЯ ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ
Метод колоночной жидкостной хроматографии (КлЖХрГ) впервые был предложен в 1906 г. как метод разделения смеси веществ, позволяющий осуществлять эту операцию как на микроуровне, так и при решении препаративных задач.
Неподвижную фазу помещают в колонку, затем вносят в нее анализируемую смесь (биопробу) и элюируют соответствующим растворителем (ПФ). При продвижении по колонке компоненты смеси по-разному удерживаются сорбентом в зависимости от своих физико-химических свойств и, следовательно, перемещаются с разной скоростью. На выходе колонки разделяемые вещества появляются в определенной последовательности и могут быть собраны в виде отдельных фракций.
В (КлЖХрГ) конечный результат зависит не только от того, насколько принцип разделения (адсорбция, распределение, ионообмен или гель-хроматография) соответствует свойствам анализируемых веществ, но и от множества других факторов:
— свойств системы сорбент-элюент;
— условий элюирования (скорость потока, температура, вяз-кость элюента);
— конструкции и размеров колонки;
— нагрузки колонки (количество пробы);
— качества упаковки колонки;
— размеров частиц, среднего диаметра пор частиц сорбента;
— конструкции основных элементов хроматографической сис-темы (блок ввода пробы, мертвый объем в соединительных шлангах и ячейке детектора);
—качества подготовки пробы.
Качество разделения (эффективность работы колонки) зависит также от равномерности ее упаковки и от скорости установления равновесия между актами адсорбции — десорбции вещества.
Основное преимущество (КлЖХрГ) перед газовой состоит в возможности разделения веществ при более низких температурах (в диапазоне от температуры замерзания до кипения растворителя), поэтому этот метод позволяет разделять термически неустойчивые вещества (например, белки), которые нельзя испарить без разрушения.
ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ НИЗКОГО ДАВЛЕНИЯ
В жидкостной хроматографии низкого давления компоненты смеси разделяют в хроматографической колонке при нормальном (гидростатическом) или несколько повышенном давлении. С помощью этого варианта можно разделять разнообразные вещества — от низкомолекулярных соединений до сложных биополимеров и их комплексов.
Факторами, обеспечивающими оптимальное разрешение, являются: небольшие размеры частиц сорбента и их возможно более узкий фракционный состав, небольшая скорость подачи элюента и малая вязкость элюента (вследствие чего быстро устанавливается диффузионное равновесие), возможно более высокая температура.
Обычно разделение на мягких сорбентах (сефадексы, биогели, гели агарозы и полистирольные гели) проводят при атмосферном давлении. Этот вид хроматографии применяют для переработки больших объемов жидкости, когда не ставится задача достижения высокого разрешения и нет ограничений по продолжительности эксперимента. Если скорость подачи ПФ достаточно высока, то частицы сорбента должны иметь сравнительно крупные размеры. В аналитических лабораториях колончатую (ЖХрГ) низкого давления проводят на сорбентах с диаметром частиц 40...60 мкм, в производственных условиях — с диаметром 100...200 мкм и более.
Коротко опишем основную аппаратуру, необходимую для проведения данного типа (ЖХрГ).
Хроматографическая система (рис. 4.4.) включает: резервуар или градиентный смеситель для размещения ПФ, насос для подачи ПФ, устройство ввода пробы, колонку, детектор для обнаружения компонентов пробы в элюате, самописец, автоматизированный коллектор для сбора фракций.
Устройства ввода пробы. Непосредственное внесение биопробы осуществляется при помощи пипетки или тефлонового капилляра, конец которого (длиной ≈ 3 мм) изогнут под углом 90°. Биопробу с высоким удельным весом помещают под слой растворителя на столбик сорбента при помощи специального адаптера—поршня, который ограничивает высоту слоя сорбента в колонке. Большие объемы жидкости подают на колонку из резервуаров через систему специальных кранов. Иногда биопробу вносят при помощи дозирующей петли, которую при нормальном давлении заполняют раствором биопробы, после чего переносят ее в колонку. Этот способ применяют при внесении небольших объемов. Биопробу предварительно фильтруют или центрифугируют для того, чтобы отделить коллоидные частицы и механические примеси.
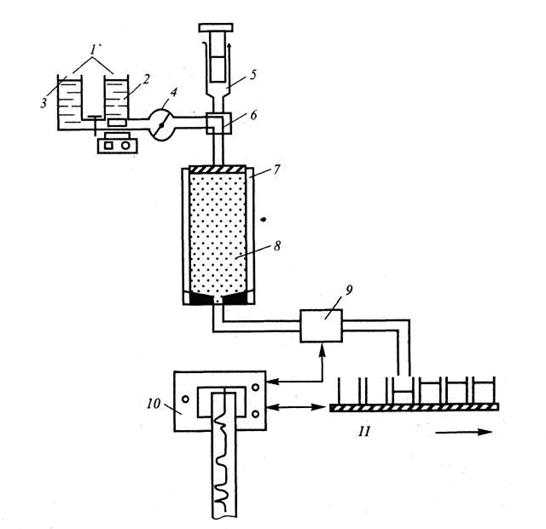
Рис. 4.4. Общая схема хроматографической установки для ЖХрГ низкого давления:
Градиентный смеситель; 2 – смеситель; 3 – резервуар; 4 – насос; 5 – проба; 6 – вентиль переключения потока; 7 – адаптер; 8 – сорбент; 10 – самописец; 11 – коллектор для сбора фракций
Колонки. Конструкция колонки имеет первостепенное значение для эффективности разделения. Для изготовления деталей, контактирующих с органическими растворителями, в них используют инертные материалы (стекло, тефлон, нержавеющая сталь).
Скорость элюента (ПФ) устанавливают в зависимости от типа сорбента и свойств разделяемых веществ. В адсорбционной и ионообменной хроматографии удовлетворительное разделение получают при высокой скорости элюирования, в гель-хроматографии скорость элюирования не должна превышать 10 см/ч (фронт элюента перемещается по колонке на расстояние 10см за 1 ч). Эта так называемая линейная скорость подачи элюента не зависит от размеров колонки. При анализе высокомолекулярных веществ скорость подачи элюента должна быть на порядок меньше. В хроматографии при нормальном давлении действует правило: чем меньше скорость элюирования, тем выше качество разделения.
После разделения в колонке выходящие фракции поступают в хроматографический детектор — прибор, позволяющий регистрировать появление компонента смеси в потоке ПФ по его характерным физико-химическим свойствам (окраске, флуоресценции, поглощению излучения и др.), где производится их количественный анализ. Более подробно детекторы рассмотрены в специальной литературе.
При проведении препаративной хроматографии элюат собирают по фракциям на фракционном коллекторе, причем смена фракций в зависимости от типа коллектора может происходить по истечении заданного промежутка времени, при достижении заданного объема фракции или сбора заданного числа капель.
 низкого давления, как правило, применяется для препаративного разделения неорганических (ионообменная хроматография), Органических (адсорбционная и распределительная хроматография) веществ и биополимеров (ионообменная, аффинная, гель-хроматография).
низкого давления, как правило, применяется для препаративного разделения неорганических (ионообменная хроматография), Органических (адсорбционная и распределительная хроматография) веществ и биополимеров (ионообменная, аффинная, гель-хроматография).
Лекция №9
ВЫСОКОЭФФЕКТИВНАЯ ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ
Высокоэффективная жидкостная хроматография ВЭ(ЖХрГ) представляет собой метод разделения веществ на мелкозернистых сорбентах (с размерами частиц 3...15 мкм) при повышенном давлении. Метод характеризуется высокой эффективностью разделения в сочетании с высокой скоростью процесса. Принципиально ВЭ(ЖХрГ) мало отличается от (ЖХрГ) низкого давления, однако из-за высокого рабочего давления (до 4,107 Па) приборы для высокоэффективной (ЖХрГ) существенно отличаются. Вследствие небольших размеров частиц сорбента и их однородности разделяющая способность колонок для этого метода существенно выше. Высокое разрешение, а следовательно, возможность использования коротких колонок позволяют сократить продолжительность процесса и уменьшить расход растворителей. Обязательными также являются высокое качество устройства ввода пробы и минимальный объем измерительной ячейки детектора.
К подвижным фазам предъявляются особые требования:
— высокое качество очистки (особо чистые растворители);
— отсутствие взвешенных частиц (фильтрование на входе колонки на фильтре с диаметром пор менее 4 мкм)
— минимальная вязкость;
— учет условий работы детектора (растворитель не должен поглощать при рабочей длине волны);
— отсутствие ионов, способных вызывать коррозию металлических частей хроматографа.
Структурная схема многоцелевого жидкостного хроматографа, использующего методику градиентного элюирования, представлена на рис. 4.5. Из крана-смесителя жидкая ПФ под высоким давлением поступает в хроматограф, который находится в термостате, сначала — через змеевик, где она принимает рабочую температуру, затем — через предколонку с той же насадкой, что и основная колонка. Предколонка выполняет следующие функции:
—достижение равновесия между ПФ и сорбентом;
—роль фильтра, удаляющего оставшиеся примеси.
Биопробу вводят между предколонкой и основной колонкой. Элюат из колонки проходит через измерительную ячейку дифференциального детектора к коллектору фракций или сливу. Поток элюента, проходящего через сравнительную ячейку детектора, отделяют от основного потока элюента до ввода биопробы. В более простых и дешевых системах могут отсутствовать следующие блоки: змеевик (нет контроля температуры), предколонка, а также может использоваться более простой детектор.
Градиентный смеситель. Наиболее простой моделью градиентного смесителя является система из двух сообщающихся сосудов, также применяемая в (ЖХрГ) низкого давления. Более современные модели градиентных смесителей снабжены клапанами, управляемыми при помощи микропроцессоров. Преимущество таких моделей заключается в том, что для создания градиента концентрации достаточно одного насоса. Иногда используют модель с двумя насосами в едином блоке с микропроцессором. В этом случае градиент формируют в области высоких давлений, т. е. на входе в колонку. В большинстве случаев вполне достаточно однократной дегазации растворителей путем выдерживания их в вакууме.
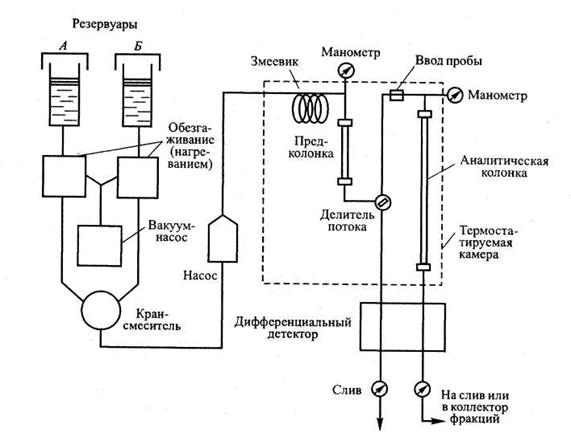
Рис. 4.5. Технологическая схема типичного жидкостного хроматографа с приспособлением для градиентного элюирования
Устройства ввода биопробы. В настоящее время редко пользуются шприцами для ввода биопроб, так как к ним предъявляются высокие требования по герметичности. Чаще всего используют петлевые дозаторы, которые позволяют вводить ее при рабочем давлении.
Колонки представляют собой трубки из нержавеющей стали с хорошо отполированной внутренней поверхностью. Применение коротких колонок и сорбентов с диаметром частиц 5 мкм и менее позволяет достигнуть очень высокого разрешения при небольших затратах. Наиболее распространенными являются колонки следующих типов:
—колонки для аналитического разделения размером 4x250 или 4 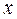 125 мм
125 мм
—колонки для препаративного разделения с внутренним диаметром 8, 10, 16мм и длиной 250 и 500мм.
Сорбенты. Для всех вариантов высокоэффективной ЖХрГ, за исключением аффинной хроматографии, выпускаются специальные сорбенты (некоторые из них были рассмотрены ранее). Трудности появляются при работе с мелкими фракциями, в частности, сложной проблемой является приготовление стабильных суспензий. Высокой воспроизводимости упаковки достигают также при использовании поверхностно-пористых сорбентов (непористое ядро и пористый поверхностный слой) с частицами диаметром 20...30 мкм. Эти сорбенты обладают небольшой емкостью и используются, главным образом, для аналитических целей.
Областями применения этого вида ХрГ являются ускоренный анализ разнообразных смесей при высоком разрешении, высокой чувствительности и хорошей воспроизводимости, а также препаративное разделение веществ в количестве от нескольких миллиграммов до нескольких граммов.
КОЛОНОЧНАЯ ГАЗОВАЯ ХРОМАТОГРАФИЯ
ОСНОВНЫЕ ПРИНЦИПЫ
Колоночная газовая хроматография КлГХрГ является методом разделения летучих веществ: газов (при нормальной температуре) или паров (при повышенной температуре). В качестве неподвижной фазы в ГХрГ используются твердые материалы (насадочные или набивные колонки), твердые материалы, покрытые слоем жидкости, или же капилляры с нанесенным на внутреннюю поверхность слоем жидкости (капиллярные колонки). В качестве ПФ используют газ-носитель, переносящий разделяемые вещества через колонку. Разделение анализируемой смеси осуществляется за счет различного времени удерживания компонентов пробы в неподвижной фазе.
Основные группы органических веществ, которые могут быть определены методом ГХрГ, включают газы, летучие жидкие соединения, твердые частицы, жидкие аэрозоли и главным требованием для веществ, разделяемых ГХрГ, является их достаточная устойчивость при температурах, которые необходимы для поддержания биопробы в газообразном состоянии.
Между жидкостной и газовой хроматографией не существует принципиальной разницы. ГХрГ отличается лишь свойствами подвижной фазы: высокой скоростью диффузии газа-носителя и его способностью сжиматься. Достоинствами газовой хроматографии являются:
— возможность идентификации и количественного определения индивидуальных компонентов сложных смесей;
— возможность анализа широкого круга объектов — от легких газов до ВМ органических соединений и некоторых металлов;
— высокая четкость разделения и быстрота процесса, обусловленная низкой вязкостью ПФ;
— возможность исследования микропроб и автоматизация записи получаемых результатов, обусловленная наличием чувствительных и малоинерционных детекторов;
— возможность выделения чистых веществ в промышленных масштабах;
— пригодность для исследования малых объемов жидких биопроб (0,01…50 мкл).
Максимальная разделяющая способность колонки в ГХ зависит от:
— количества НФ, качества упаковки, толщины слоя;
— размера (диапазона размеров) частиц материала-носителя;
— размеров колонки;
— вязкости газа-носителя (а следовательно, и температуры в колонке).
В зависимости от состояния неподвижной фазы различают газоадсорбционную ГАдХрГ и газожидкостную (или распределительную) хроматографию ГЖХрГ. В ГАдХрГ в качестве НФ используется адсорбент, а в основе разделения лежит механизм адсорбции; в ГЖХрГ неподвижной фазой является жидкость, нанесенная на инертный материал-носитель, а в основе разделения лежит распределительный механизм. Растворимость анализируемых веществ в НФ определяется зависимостью давления паров растворенного вещества от его концентрации в жидкой фазе.
Вид хроматограммы, полученной в изотермических условиях, представлен на рис. 4.7. Время удерживания конкретного компонента в колонке зависит от вероятности попадания молекул вещества в ПФ. При этом компоненты с высоким давлением паров и соответственно низкой растворимостью в НФ удерживаются слабее и, наоборот, вещества с низким давлением пара и высокой растворимостью элюируются позже. Если в процессе разделения температуру повышают, то говорят 6 газовой хроматографии при программируемой температуре.
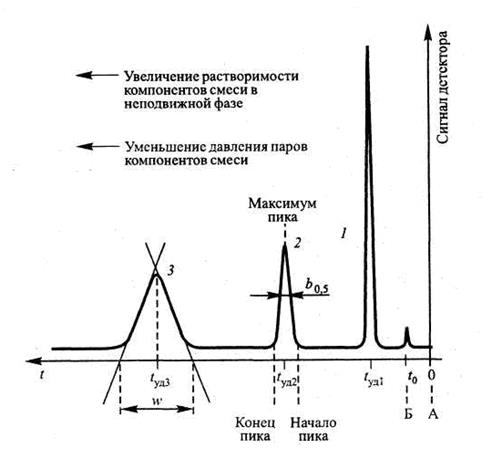
Рис. 4.7. Хроматограмма, полученная в изотермических условиях
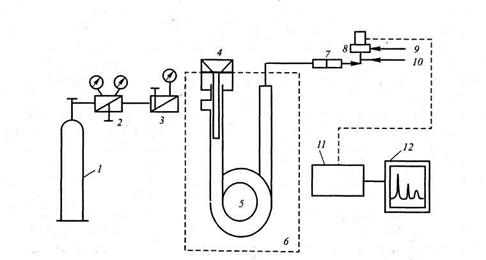
Рис. 4.8. Схема газового хроматографа:
Баллон с газом-носителем; 2 — игольчатый вентиль баллона; 3—регулятор потока газа-носителя(дроссель); 4— дозирующее устройство (блок ввода пробы); 5— хроматографическая колонка; 6 — термостат; 7 —ротаметр; 8 — детектор (пламенно-ионизационный); 9 и 10 — система для подачи газов в детектор (водород и воздух в случае ПИД); 11 — электронный блок обработки сигнала (интегратор); 12 — самописец
Обобщенная схема установки для ГХрГ приведена на рис. 4.8. В ГХрГ применяют три типа колонок (рис. 4.9.).
1. Насадочные колонки. Такие колонки изготавливаются из стеклянных или металлических трубок (нержавеющая сталь) U-образной или спиралевидной формы. Они характеризуются большой поверхностью и высокой разделяющей способностью, однако обладают большим сопротивлением, что ведет к неравномерности потока газа-носителя. Хотя теоретически разделяющая способность растет с увеличением длины колонки, на практике преимущество длинных колонок сводится на нет из-за увеличения сопротивления. Оптимальной длиной насадочной колонки является 0,5... 10 м при внутреннем диаметре 1...5.мм.
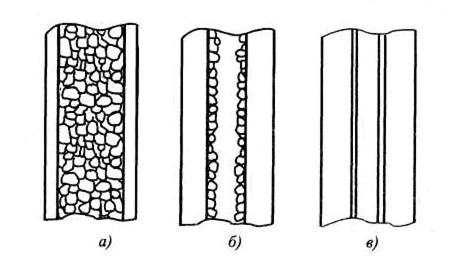
Рис. 4.9. Типы колонок для ГХрГ:
Дата добавления: 2016-08-08; просмотров: 12049;
