РОЗДІЛ ІІ. БІЛКИ: БУДОВА, ВЛАСТИВОСТІ ТА ЇХ ФУНКЦІЇ
Найважливішими біомолекулами є білки. У 1838 р. голландський вчений Мюльдер відобразив їх значення в назві “протеїни” (від грецького "протос" – первинний). На білки припадає не менше 50 % сухої маси клітини. За хімічною будовою білки – це біополімери, які складаються із залишків амінокислот, з’єднаних пептидними зв’язками. Для хімічного складу білків характерний постійний середній вміст нітрогену - близько 16%.
Білки належать до незамінних, есенціальних речовин, без яких неможливе життя, зростання та розвиток організму. Це зумовлено фізіолого-гігієнічними функціями, які виконують білки харчового раціону в організмі людини:
Важливі біологічні функції:
а) каталітичну - найсуттєвішу, так як переважна більшість перетворень в організмі здійснюється тільки під впливом каталізаторів – ферментів, які є білками;
б) структурну - білки в тварин утворюють рогові покриви, є основою сполучення між клітинами (на структурний білок сполучної тканини колаген припадає третина всіх білків організму за масою);
в) рухову (скорочувальні білки в усіх живих організмів побудовані та функціонують за спільним принципом, наприклад, актин і міозин у м’язовому волокні);
г) транспортну - переносять гази (гемоглобін, міоглобін), залишки жирних кислот (альбумін крові), здійснюють активний транспорт багатьох речовин через мембрану;
д) регуляторну - швидкість біохімічних перетворень регулюють зокрема гормони гіпофізу, підшлункової залози, які є білками або похідними амінокислот, нейроолігопептиди забезпечують в головному мозку складні психічні та фізіологічні явища (пептид страху, пам’яті тощо), білки є регуляторами зчитування спадкової інформації з ДНК, рецепторами мембран, які забезпечують трансформацію і передачу в клітину інформації (гормонального сигналу);
е) захисну - антитіла, які виробляються в результаті появи чужорідних молекул, зв’язують і знешкоджують їх - білки, серед них - інтерферон – єдиний відомий білок, який знешкоджує чужорідну нуклеїнову кислоту; токсини, наприклад ботулізму, є захисними молекулами для організму, який їх виділяє;
є) енергетичну - при повному окисненні 1 г білка виділяється близько 17 кДж енергії, проте білки не відкладаються про запас, а при їх розщепленні вивільняється токсичний продукт – аміак, на детоксикацію якого витрачається енергія. Половина амінокислот, які утворюють білки, в організмі людини не синтезується і повинна надходити з їжею, тому використання білків в енергетиці є для організму вимушеним, пов’язаним із незбалансованим вмістом в їжі амінокислот, необхідних для побудови білків.
Таким чином, білки забезпечують більшість життєвих проявів. Найпростішим живим організмом, який здатний реалізувати свою спадкову інформацію, є вірус – комплекс нуклеїнової кислоти і білка (вірус біологи жартома називають кепською новиною у білковому конверті).
До складу білків належать a-амінокислоти, тобто такі, в яких аміногрупа розташована біля другого атома С. Між аміно- і карбоксильною групами знаходиться тільки один a-С атом. У процесах обміну речовин утворюються і інші види амінокислот. Наприклад, g-аміномасляна кислота (ГАМК) - є медіатором центральної нервової системи. Амінокислоти досить поширені в природі й відіграють велику роль у життєдіяльності рослинних та тваринних організмів. Амінокислоти, що входять до складу білків, а їх більше 20, називаються протеїногенними. З них ті, які потрібні для росту та нормального розвитку організму і не синтезуються в ньому, а засвоюються готовими з їжі, називаються незамінними. До них належать: валін, лейцин, ізолейцин, лізин, фенілаланін, метіонін, триптофан, треонін, гістидин і аргінін.
Відомо 20 a-амінокислот, які генетично кодуються, і декілька їх похідних, що утворюються шляхом ферментативної модифікації. Загальну формулу a-амінокислоти можна зобразити так:
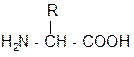
де R- вуглеводневий радикал.
Радикал може бути аліфатичний або циклічний, містити різні функціональні групи. Одна із двадцяти a-амінокислот (пролін) є не аміно-, а імінокислотою, тому що її атом азоту входить до складу циклу. Амінокислоти можна класифікувати за різними ознаками. Для вивчення білків зручний поділ за полярністю радикалів на неполярні, полярні незаряджені та полярні заряджені (позитивно або негативно) (табл.14.) Тривіальні назви амінокислот є найбільш вживаними. У схемах амінокислоти та їх залишки позначаються скорочено першими трьома буквами назви.
Таблиця 14.
Класифікація амінокислот за полярністю радикалу*
Неполярний радикал
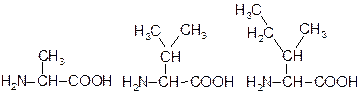
Аланін (Aла, Ala, A) Валін (Вал, Val, V) Ізолейцин (Ілей, Ile, I)
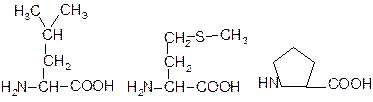
Лейцин (Лей, Leu, L) Метіонін (Мет, Met, M) Пролін (Про, Pro, P)

Фенілаланін (Фен, Phe, P) Триптофан (Три, Trp, W)
Полярний незаряджений радикал

Гліцин (Глі, Gly, G) Серин (Сер, Ser, S) Цистеїн (Цис, Cys, C)

Треонін Аспарагін Глутамін Тирозин
(Тре, Thr, T) (Асн, Asn, N) (Глн, Gln, Q) (Тир, Tyr, Y)
Полярний заряджений радикал
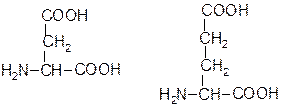
Аспарагінова кислота (Aсп, Asp, D) Глутамінова кислота (Глу, Glu, E)
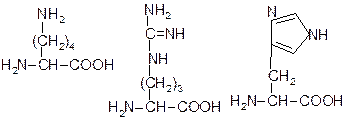
Лізин (Ліз, Lys, K) Аргінін (Арг, Arg, R) Гістидин (Гіс, His, H)
* у дужках подаються скорочені українська і англійська назви та міжнародний символ
Структура білків
До складу білків входить в основному 20 різних альфа-амінокислот, які сполучені між собою у певній послідовності.
Пептидний зв¢язок. Амінокислоти здатні до конденсації при взаємодії карбоксильної групи однієї амінокислоти та аміногрупи - іншої:
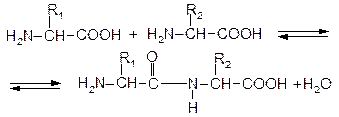
Утворена сполука називається пептидом, а зв'язок - пептидним. При сполученні двох амінокислот утворюється дипептид, трьох - трипептид, а багатьох - поліпептид. Пептидний зв'язок міцний, він піддається гідролізу тільки при тривалому кип'ятінні в кислому або лужному середовищі.
Наявність пептидного зв'язку визначають біуретовою реакцією, характерною для амідів, зокрема, для біурету: Першим біуретову реакцію пептидів вивчав О. Я. Данилевський. Суть її полягає у взаємодії пептидної групи з йонами міді (II) у лужному середовищі з утворенням розчинного комплексу фіолетового кольору. Ця реакція дуже чутлива і використовується як для якісного, так і для кількісного визначення пептидів.
Білок + Сu(OH)2 + NaOH → фіолетове забарвлення
Дисульфідні зв’язки мають велике значення у формуванні третинної структури білків. Утворюється внаслідок відщеплення іонів Гідрогену від сульфідних груп двох амінокислотних залишків цистеїну:
SH + HS- → - S-S- + 2H+
У білків розрізняють чотири рівні структурної організації – первинну, вторинну, третинну й четвертинну.
Первинна: певна послідовність залишків альфа амінокислот у поліпептидних ланцюгах молекул білка.
Вторинна: просторова конфігурація поліпептидного ланцюга. Існує у вигляді альфа-спіралі, спіраль закручена вправо, та бета-складчастої структури – виникає, коли поліпептидні ланцюги складаються у пачки.
Третинна: це структура, яка виникає, коли поліпептидні ланцюги укладаються, утворюючи структуру близьку до сферичної. Укладені поліпептидні ланцюги можуть мати спаралізовані й лінійні ділянки.
Четвертинна: характерна для тих білків, молекули яких складаються з двох, чотирьох, і більше поліпептидних ланцюгів. Четвертинну структуру мають білки, які виконують складні біологічні функції і активність яких залежить від дії регулюючих факторів.
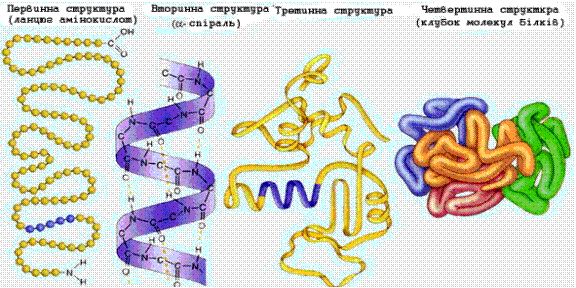
Рис.4. Первинна, вторинна, третинна та четвертинна структура білків
Таким чином, порядок утворення білкової глобули можна уявити схематично так: первинна структура ® вторинна структура (a-спіралі і b-складчасті шари) ® зверхвторинна структура (суперспіраль, система регулярно розташованих шарів) ® домен (автономна компактна система, яка об’єднує декілька сусідніх структурних сегментів) ® третинна структура ® четвертинна структура (рис.4). Багато білків функціонують лише в складі надмолекулярних комплексів з іншими білками, ліпідами, мембранами. Тому деякі автори виділяють п¢ятеринну структуру білка як спосіб його включення в надмолекулярні структури.
Дата добавления: 2016-06-13; просмотров: 1227;
