ЛАБОРАТОРНА РОБОТА №2.
ЯКІСНЕ ДОСЛІДЖЕННЯ ПРИРОДНОЇ ВОДИ
Теоретичний вступ
Хімічний склад природних вод представлений складним комплексом розчинених газів, різних мінеральних солей та органічних сполук. У природних водах розчинені майже всі відомі на землі хімічні елементи, з яких чітко визначено різними фізико-хімічними методами понад 80 елементів. Зі збільшенням порядкового номера в таблиці Д.Менделєєва спостерігається зменшення концентрації елементів у природних водах. Хімічні компоненти природних вод поділяють на п’ять груп (класифікація О.Альокіна):
1) головні йони (макрокомпоненти) – K+, Na+, Mg2+, Ca2+, Cl-, SO42-, HCO3-, CO32-;
2) розчинені гази – кисень (О2), азот (N2), сірководень (H2S), карбон (IV) оксид (вуглекислий газ СО2) тощо;
3) біогенні речовини – сполуки Нітрогену, Фосфору, Феруму та Силіцію;
4) органічні речовини – різноманітні сполуки, які належать до органічних кислот, фенолів, гумусових речовин, нітрогенвмісних сполук (білки, амінокислоти, аміни) та багатьох інших;
5) мікроелементи – йони всіх металів, крім головних йонів, а також деякі інші компоненти, які містяться у водах в невеликих кількостях, наприклад, радіоактивні елементи.
1. Головні компоненти (головні йони)
До головних компонентів природних вод належать йони солей калію, натрію, кальцію та магнію хлоридної, сульфатної та карбонатної кислот. Головні компоненти складають основну частину мінерального складу природних вод: в прісних водах – понад 90-95%, у високомінералізованих - понад 99%.
В маломінералізованих водах переважають йони НСО3- і Са2+, у високомінералізованих – С1- і Na+, йони Mg2+ займають проміжне положення між Na+ та Са2+, як і йони SO42- - між йонами НСО3- та С1-.
Зміна складу води відповідно до величини загальної мінералізації пояснюється різницею розчинності хлоридів, сульфатів та карбонатів лужних і лужноземельних металів. Мала розчинність карбонатних солей кальцію обмежує концентрацію гідрогенкарбонатних та карбонатних йонів в межах до 1000 мг/л. Порівняно невелика розчинність кальцій сульфату також обмежує вміст сульфатних йонів. Тільки хлоридні йони можуть досягати найбільших концентрацій внаслідок великої розчинності солей хлоридної кислоти.
Одною з найважливіших закономірностей складу природних вод є зміна концентрацій переважаючих йонів за схемою
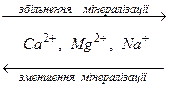
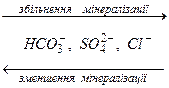
В прісних водах на гідрогенкарбонати припадає близько 60% загальної кількості солей, а на хлориди – менше 10%; в морській воді на хлориди припадає близько 80%.
Хлоридні йони присутні майже в усіх природних водах. Йони С1- не засвоюються рослинами та бактеріями. Вони виділяються у вільному стані організмами тварин.
В солоних озерах, а також в розсолах підземних вод вміст хлорид них йонів може досягати сотень г/кг.
Сульфатні йони, як і йони С1-, поширені в поверхневих природних водах, поступаючись хлоридним йонам у високомінералізованих водах, але превалюючи в більшості мало- і помірномінералізованих вод. Вміст сульфатних йонів, на відміну від хлоридних, лімітується присутністю йонів Са2+, які утворюють з йонами SO42- малорозчинний СаSO4 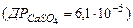 . При малому вмісті йонів Са2+ концентрація йонів SO42- може значно збільшуватись.
. При малому вмісті йонів Са2+ концентрація йонів SO42- може значно збільшуватись.
Сульфатні йони - біологічно нестійкі і при відсутності кисню (анаеробні умови) можуть бути відновлені до сірководню. Такий процес, який називається сульфаторедукцією, відбувається, наприклад, в глибинах деяких морів і водах нафтоносних родовищ. Він відбувається під дією бактерій (Microspira) в присутності органічної речовини і може бути виражений такою схемою:
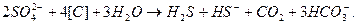
Присутність сульфатредукуючих бактерій виявлено у водах нафтоносних родовищ на глибинах до 2000м. В подальшому сірководень при стиканні з повітрям знову окиснюється до вільної сірки
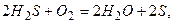
а потім - до SO42-.
При відновленні сульфатів, утворюється гідрогенсульфідний йон HS-, який зв’язаний з H2S рівнянням першого ступеня дисоціації сульфідної кислоти
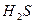 L
L 
Розрахунок співвідношень молярних концентрацій H2S і HS- в залежності від концентрації йонів Гідрогену показує, що при рН нижче 7 основною формою в розчині є H2S, а при рН більше 7 -переважають йони HS-.
Йони Натрію за поширенням серед катіонів стоять на першому місці, складаючи більше половини загального вмісту всіх катіонів в природних водах. Подібно до йонів С1- йони Na+ переважають в сильномінералізованих водах. В маломінералізованих водах їх вміст дуже невеликий, в межах декількох мг/л. З підвищенням мінералізації вміст йонів Натрію сильно збільшується.
Концентрація йонів К+ значно нижча за вміст йонів Na+. Найбільша кількість йонів К+ спостерігається в маломінералізованих водах, при підвищенні мінералізації концентрація йонів К+ спадає. Більший вміст йонів Na+ в порівнянні з йонами К+ пояснюється, з одного боку, кращим поглинанням йонів К+ поглинальним комплексом грунтів і порід, а , з другого боку, тим, що йон К+, необхідний для живлення рослин, поглинається ними в більших кількостях, ніж йон Na+.
У вивержених породах вміст Na+ і К+ майже однаковий, а в морській воді в результаті поглинання йонів К+ породами вміст його вже значно менший. Отже, незважаючи на меншу розчинність солей натрію, йони Na+ значно поширені в природних водах.
2. Розчинені гази
В природних водах завжди присутні гази в розчиненому стані. Якісний і кількісний склад їх залежить від природних умов, в яких знаходиться вода.
Виникнення цих газів пов’язане:
1) зі складом атмоcфери (N2, O2, CO2, інертні гази);
2) з біохімічними процесами (CO2, CH4, H2S, N2, H2);
3) з процесами дегазації мантії в глибинних шарах земної кори при високих температурах і тиску (CO2, CO, H2S, H2, CH4, NH3, HCl та інші сполуки Гідрогену з галогенами).
Перша група газів є характерною, головним чином, для вод земної поверхні, друга – для поверхневих і підземних вод, третя - переважно для підземних вод.
Найбільш поширені в поверхневих водах О2 і СО2, в підземних – H2S і CН4.
Кисень знаходиться в природних водах у вигляді молекул. На вміст кисню у воді впливає дві групи протилежно напрямлених процесів: одні – збільшують концентрацію кисню, інші – зменшують її.
До першої групи процесів, які збагачують воду киснем, належать: 1) процес абсорбції кисню з атмосфери; 2) виділення кисню водною рослинністю в процесі фотосинтезу. Збагачення води киснем при абсорбції може відбуватись тільки в тому випадку, якщо вода є ненасичена ним, тобто вміст кисню в ній менший, ніж має бути при даній температурі і тиску. Отже, цей процес можу відбуватись тільки на поверхні водойми.
Виділення кисню в результаті фотосинтезу відбувається при асиміляції карбон(IV) оксиду водною рослинністю. Процес фотосинтезу проходить тим сильніше, чим вища температура води, інтенсивність сонячного освітлення і більше поживних речовин (P, N та інші). Він може відбуватись не тільки на самій поверхні водойми, але в більшості випадків і на невеликих глибинах в залежності від прозорості води.
До другої групи процесів, що зменшують вміст кисню у воді, належать процеси, які пов’язані з використанням його для окиснення органічних речовин. Це відбувається при біологічних (дихання організмів), біохімічних (дихання бактерій) і хімічних (окиснення Fe2+, Mn2+, NO2-, H2S та інших) процесах.
Окрім того, зменшення вмісту кисню у воді може відбуватись внаслідок виділення його в атмосферу. Це може відбуватись тільки в тому випадку, якщо вода при даній температурі і тиску перенасичена киснем.
Концентрація розчиненого кисню в природних водах коливається в певних межах, які лімітуються законом Генрі-Дальтона (від 0 до 14 мг/л).
Присутність кисню в природних водах має дуже велике значення. Перш за все, кисень необхідний для існування більшості водних організмів. Як сильний окисник кисень відіграє важливу саніторно-гігієнічну роль, сприяючи швидкій мінералізації решток організмів.
Карбон(IV) оксид (вуглекислий газ) знаходиться у воді головним чином у вигляді розчинених молекул газу. Однак частина їх (≈1%) вступає у взаємодію з водою, утворюючи карбонатну кислоту
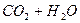 L
L 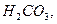
(СО2 + Н2СО3) – вільна карбонатна кислота.
В природних водах джерелом СО2 є , перш за все, процеси окиснення органічних речовин, які відбуваються з виділенням вуглекислого газу. До них належать дихання водних організмів, різні види біохімічного розпаду та окиснення органічних решток. В деяких підземних водах джерелом СО2 є вулканічні гази, які виділяються з надр Землі. Поглинання водою вуглекислого газу з атмосфери має важливе значення для вод морів і океану.
Зменшення вмісту СО2 в природних водах, перш за все, відбувається при фотосинтезі. Карбон(IV) оксид витрачається також на розчинення карбонатів
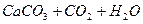 L
L 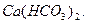
Вміст СО2 в природних водах дуже різноманітний – від декількох десятих до 2-3 тис.мг/л. Найменший вміст СО2 спостерігається в морях, солоних озерах, найбільший - в підземних і забруднених стічних водах. В річках і озерах концентрація СО2 рідко перевищує 20-30 мг/л. Незважаючи на малу концентрацію в поверхневих водах, СО2 має важливе життєве значення. Якщо можливість існування тваринних організмів залежить від наявності кисню, то СО2 має таке ж значення для рослинних організмів як джерело Карбону.
З інших газів найбільш постійним газом в природних водах є розчинений молекулярний азот.
Значно більше значення має розчинений сірководень. В річках і озерах сірководень присутній лише іноді в придонних шарах. Зустрічається також в деяких придонних океанських водах. Значно частіше перебуває сірководень в підземних водах, ізольованих від поверхні, а також в сильно забруднених поверхневих водах.
З інших газів слід відмітити також метан СН4, він міститься у глибинних підземних водах під великим тиском. В невеликих кількостях метан присутній в придонних шарах озер, де він виділяється з мулу при розкладанні органічних решток.
3. Органічні речовини
За походженням органічні речовини природних вод можуть бути розподілені на дві групи: 1) надходять зовні (аллохтонні); 2) утворюються в самій водоймі (автохтонні).
Запаси аллохтонних органічних речовин поповнюються за рахунок виносу їх з водозбірної площі, надходженням з атмосферними опадами, а також іноді з побутовими та промисловими стоками.
Рештки рослинних і тваринних організмів під дією фізичних, хімічних та біохімічних чинників можуть розпадатись з утворенням простіших неорганічних сполук. Але іноді при недостатньому доступі кисню утворюється комплекс органічних сполук, який має назву гумус.
В гумусі містяться гумінові та фульвокислоти. Це високомолекулярні сполуки з рядом функціональних груп. Гумусові кислоти мають велике значення для формування складу природних вод. Маючи велику кислотність, вони, поряд з СО2, надають воді агресивність до гірських порід. Гумусові кислоти утворюють комплексні сполуки з різними металами, які легко засвоюються рослинами.
Друга група органічних речовин обумовлена процесами утворення первинної органічної речовини і її розкладу. Первинна органічна речовина утворюється синтезуючими рослинами і бактеріями. Різні організми споживають її і утворюють більш складні види органічної матерії. В результаті цього у воду надходять як продукти життєдіяльності цих організмів, так і тіла відмерлих організмів. Всі зміни, які відбуваються з органічною речовиною, пов’язані з життєдіяльністю бактерій. Мікроорганізми перетворюють складні органічні речовини в більш прості. Енергія, що виділяється, є джерелом їх існування.
Розпад органічної речовини в природних водах - мінералізація має важливе значення, як для знищення решток організмів і продуктів їх життєдіяльності у водоймах, так і для повернення у воду ряду елементів (N, P,C тощо), необхідних для живлення водних рослин.
Для річок основне значення мають органічні речовини, які надходять зовні, а для океану - ті, які утворюються в його водній масі.
Загальна концентрація органічної речовини найбільшою буває в болотних водах та в річках з болотним живленням і досягає іноді 50 мг/л і навіть вище.
Незабруднені води містять мало органічних речовин. Наприклад, в океані концентрація органічних речовин складає близько 3 мг/л, а в річках – в середньому 20 мг/л.
Надійного прямого методу визначення органічної речовини поки не існує. Користуються непрямими показниками вмісту органічної речовини. Одним з них є окиснюваність води, величина якої вимірюється кількістю кисню, який витрачається на окиснення органічних і деяких неорганічних речовин, що містяться в 1л води. Розрізняють перманганатну та дихроматну окиснюваність в залежності від окисника – KМnO4 або K2Cr2O7.
4. Біогенні елементи
До біогенних елементів в природних водах належать Нітроген, Фосфор, Ферум та Силіцій в різних сполуках, які виконують роль добрив для водних рослин.
Нітроген міститься в природних водах у вигляді ряду неорганічних і великої кількості різноманітних органічних сполук.
З неорганічних сполук у воді містяться амонійні NH4+, нітритні NO2- та нітратні NO3- йони.
В органічних сполуках Нітроген знаходиться, головним чином, у складі білка тканин організмів і продуктів його розкладу, які утворюються як при відмиранні самих організмів, так при розпаді продуктів їх життєдіяльності.
Неорганічні сполуки Нітрогену є необхідними для життя рослин як поживні речовини. Вони засвоюються рослинами в процесі фотосинтезу і входять до складу тканин їх організмів, а, якщо цими рослинами живляться тварини, то й до складу тваринних організмів.
Зворотний процес переходу Нітрогену з складних органічних сполук в мінеральні форми, який називається процесом регенерації біогенних елементів, може відбуватись при біохімічному розпаді органічних сполук. Кінцевим продуктом мінералізації органічних сполук, що містять Нітроген, є амоніак. Йони амонію засвоюються рослинами при фотосинтезі і можуть бути окиснені в нітрити та нітрати. Цей процес (нітрифікація) відбувається в присутності кисню під дією бактерій і проходить в дві фази. Перша фаза – перехід NH4+ в NО2- здійснюється під дією бактерій-нітрифікаторів (Nitrosomonas)
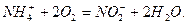
Друга фаза – окиснення нітритних йонів під дією інших бактерій (Nitrobacter) в нітратні
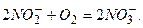
Одним з головних джерел нітратних сполук у водоймах є засвоєння молекулярного азоту мікроорганізмами та водоростями. В значних кількостях Нітроген надходить у водойми з атмосферними опадами. В індустріально розвинутих країнах атмосферні опади щорічно доставляють до 15-17 кг амонійного і нітратного Нітрогену на 1 га земельних угідь. Цей Нітроген спричиняє суттєвий вплив на зміну природного біохімічного режиму водойми. Сполуки Нітрогену при великому вмісті можуть спричиняти отруєння гідробіонтів. Найбільш токсична форма – йон NH4+. На його токсичність має вплив рН води, оскільки з підвищенням рН зростає кількість вільного амоніаку. Дуже велику токсичність мають нітрити. Нітрити окиснюють гемоглобін до метгемоглобіну, який не може переносити кисень. Нітрити при концентрації менше 1 мг/л спричиняють загибель риби. Однак, при підвищенні солоності води вони не спричиняють небезпеки для риби. Нітрати навіть у великих концентраціях не є гостротоксичними для водних тварин.
Органічні форми Нітрогену знаходяться в продуктах часткового біохімічного розпаду водних організмів.
Одним з найважливіших елементів мінерального живлення водних організмів є Фосфор. В природних водах Фосфор міститься у вигляді солей фосфатної кислоти Н3РО4 і органічних сполук. Запаси Фосфору поповнюються за рахунок вилужнювання грунту та гірських порід і біохімічного розпаду водної та наземної рослинності. Важливу роль відіграють фосфорні бактерії, які переводять нерозчинні сполуки в розчинні. Інтенсивний розвиток водоростей відбувається при вмісті мінерального Фосфору від 0,08 до 0,32 мг/л. Збільшення вмісту Фосфору до декількох міліграмів на літр свідчить про забруднення водойми.
Процесом, що зменшує вміст фосфатів у воді, є використання їх водними рослинами. Більша частина фосфатів повертається назад у воду в процесі життєдіяльності організмів або при мінералізації їх решток.
Концентрація фосфатів в природних водах дуже мала – соті, іноді десяті частки мг/л.
Силіцій є постійним компонентом складу природних вод. Частина Силіцію знаходиться у вигляді силікатної кислоти H2SiO3 та полісилікатних кислот – mSiO2.H2О. Окрім того, Силіцій міститься в природних водах у вигляді колоїдів, які ще мало вивчені: SiO2. yH2О.
Концентрація Силіцію складає декілька міліграмів на літр, в підземних водах підвищується і досягає десятків, а в гарячих термальних водах – навіть сотень міліграмів Si/л.
Процеси, які зменшують вміст Силіцію у водоймі, - це використання Силіцію водними організмами. Наприклад, діатомові водорості будують свій скелет з Силіцію. Окрім того, нерозчинна силікатна кислота витісняється карбонатною
Na2SiO3 + 4CO2 + 4H2O = H4SiO4 + 4NaHCO3.
Ферум – один з важливих біогенних елементів, він відіграє значну роль в окисному та енергетичному обміні рослинної клітини. Максимальна кількість Феруму спостерігається у водоймах, що знаходяться в регіонах з торф’яно-болотними та підзолистими грунтами. Високі концентрації Феруму мають токсичну дію. Ферум міститься у воді в сполуках з ступенем окиснення +2 та +3. Сполуки тривалентного Феруму з гуміновими речовинами утворюють бурий осад, який осідає на зябрах риб і порушує їх дихання, що може призвести до загибелі риби.
5. Мікроелементи
До цієї групи належать елементи, сполуки яких зустрічаються в природних водах в дуже малих кількостях – менших за 1 мг/л.
Мікроелементи умовно можна поділити на п’ять таких груп:
1) типові катіони (Li+, Rb+, Cs+, Be2+, Sr2+, Ba2+);
2) йони важких металів (Cu2+, Ag+, Au3+, Pb2+ тощо);
3) амфотерні комплексоутворювачі (Cr, Mo, V, Mn).
4) типові аніони (Br-, J-, F-);
5) радіоактивні елементи.
Успішне вивчення мікроелементів затруднене у зв’язку з малим вмістом в природних водах та неясністю щодо форм їх присутності в розчині.
Вивчені такі форми вмісту мікроелементів в природних водах:
1) йонно-молекулярні розчини;
2) розчинні органічні комплекси;
3) колоїдні розчини.
Перша форма виявляється найбільш складною, тому що той самий елемент, в залежності від величини рН і ох-red-потенціалу, може бути присутній у воді в різних формах дисоціації і в різних комплексах.
Більшість металів можуть утворювати органічні комплекси. До них, перш за все, належать комплекси, які утворені дво- і тривалентним Ферумом з гумусовими та іншими органічними кислотами.
Гідроксиди багатьох металів знаходяться у воді в колоїдному стані.
В йонній формі знаходяться, головним чином, однозарядні типові катіони та аніони.
Встановлено, що мікроелементи відіграють важливу роль в складі ферментів, вітамінів, а деякі з них безпосередньо впливають на організм людини. Дуже малі і дуже великі концентрації йонів Флуору спричиняють захворювання зубів, а невеликий вміст йонів Йоду спричиняє захворювання на зоб.
Більшість мікроелементів має в усіх природних водах дуже низькі концентрації – набагато нижче за 1 мг/л. Кількісною характеристикою поширення мікроелементів в земній корі може бути величина, яка називається кларком елемента.
Кларк – це масовий відсоток вмісту елемента в породі.
В природних водах існують причини, які обмежують концентрацію мікроелементів. По-перше, - це обмеження розчинності сполук багатьох важких металів постійно присутніми у воді аніонами ОН-, СО32-, Н2РО4- та НS-. Особливо велике лімітуюче значення мають йони ОН-, тому що більшість гідроксидів металів є малорозчинні. По друге, – це адсорбція. Сорбентами мікроелементів в природних водах можуть бути: 1) глинисті мінерали у вигляді зависі; 2) породи, через які фільтрується вода; 3) органічні речовини; 4) високодисперсний кальцій карбонат. Третя причина – добування мікроелементів живими організмами, для яких вони є життєво необхідними.
Експериментальна частина
1. Проба на присутність солей кальцію.
Налити в пробірку 2-3 мл досліджуваної води, додати декілька крапель розчину амоніаку і 1-2 краплі розчину амоній оксалату (NH4)2C2О4. Суміш нагріти до кипіння. За наявності білої каламуті або осаду, які утворились, зробити висновок про присутність йону Са2+.
Кількість осаду відмітити: мало, багато, дуже багато. Написати рівняння реакції.
2. Проба на присутність солей магнію.
а) Йони Mg2+ в присутності йонів Са2+ виявити не можна. Тому спочатку слід осадити йони Са2+ у вигляді СаС2О4 додаванням до води при нагріванні амоній оксалату до утворення осаду. Осад відфільтрувати і в фільтраті визначити Mg2+.
б) До 2-3 мл фільтрату додати 2-3 мл розчину натрій гідрогенфосфату Na2HPO4 і 2-3 краплі розчину амоніаку, рідину перемішати. При наявності йону Mg2+ утворюється кристалічний осад MgNH4РО4 у вигляді шовковистої каламуті.
Написати рівняння реакції.
3. Проба на присутність хлоридів.
До 3-4 мл досліджуваної води додати декілька крапель нітратної кислоти, а потім аргентум нітрату. При наявності йонів Ag+ з’являється білий осад аргентум хлориду або каламуть. Написати рівняння реакції.
4. Проба на присутність сульфатів.
До 3-4 мл досліджуваної води додати декілька крапель розбавленої хлоридної кислоти, а потім розчину барій хлориду. Утворення білого кристалічного осаду або каламуті свідчить про наявність у воді сульфат-йонів. Написати рівняння реакції.
5. Проба на присутність у воді йонів амонію NH4+.
До 3-4 мл досліджуваної води додати 3-4 краплі реактиву Несслера (K2[HgI4]+KOH). При наявності йонів амонію утворюється червоно-бурий осад або жовто-помаранчове забарвлення (при малих кількостях NH4+). Йонно-молекулярне рівняння реакції має вигляд
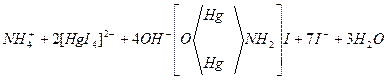
йодид меркурамонію
6. Проба на присутність у воді йонів Fe2+.
До 2-3 мл досліджуваної води додати 5-6 крапель концентрованої нітратної кислоти HNO3, а потім - стільки ж розчину амоній роданіду NH4SCN. Червоне або рожеве (при наявності слідів Fe2+) забарвлення, зумовлене кольором молекул Fe(CNS)3, свідчить про присутність йонів Fe2+.
Концентровану нітратну кислоту додають для окиснення йонів Fe2+ в йони Fe3+. Написати рівняння відповідних реакцій.
7. Проба на окиснюваність води.
До 1-2 мл досліджуваної води додати рівний об’єм концентрованої сульфатної кислоти H2SO4, потім краплями доливати концентрований розчин KMnO4. Якщо рідина тільки від однієї краплі розчину калій перманганату забарвиться у рожевий колір, який не зникає протягом 1-2 хвилин, то вода не містить речовин, що окиснюються. Якщо декілька перших крапель розчину KMnO4 знебарвлюються, то вода містить речовини, що окиснюються. Йонне рівняння реакції має вигляд
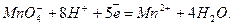
Запитання для самоконтролю
1. Як класифікують хімічні сполуки природних вод за О.Альокіним?
2. Які йони природних вод належать до головних? В складі яких неорганічних сполук вони містяться?
3. Які гази містяться в природних водах? Яке їх походження?
4. Які хімічні елементи природних вод належать до біогенних?
5. Яка існує класифікація органічних речовини природних вод?
6. В чому полягає явище нітрифікації та денітрифікації в природних водах?
7. В чому полягає сутність сульфаторедукції в природних водах?
8. Які найбільш поширені форми вмісту Нітрогену, Фосфору, Силіцію та Феруму в природних водах?
9. Яка існує класифікація мікроелементів природних вод за О.Альокіним?
10. Які причини обмежують вміст мікроелементів в природних водах?
ЛАБОРАТОРНА РОБОТА №3.
ВИЗНАЧЕННЯ АКТИВНОЇ РЕАКЦІЇ ВОДИ (рН)
Теоретичний вступ
У складі природної води йони Гідрогену займають особливе місце. Абсолютний вміст їх, у порівнянні з іншими йонами, є незначний. За вмістом вони займають майже останнє місце, поступаючись Ніколу, Кобальту, Аргентуму, Урану і багатьом іншим елементам, які рідко зустрічаються у воді. Але значення йонів Гідрогену у природних водах є надзвичайно велике. Воно обумовлене тим, що йони Гідрогену, що утворились при дисоціації у водних розчинах багатьох кислот та їх похідних, зв’язані з ними в єдину систему.
Концентрацією йонів Гідрогену кількісно характеризується активна реакція води, тобто ступінь її кислотності або лужності.
1. Електролітична дисоціація води. Йонний добуток води. Водневий показник
Електростатична взаємодія полярних молекул води призводить до їх самойонізації: 2Н2О L Н3О+ + ОН- або в спрощеній формі Н2О L Н+ + ОН-. Константа дисоціації води
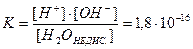 при 250С.
при 250С.
Дуже незначна дисоціація води дозволяє вважати, що концентрація недисоційованих молекул дорівнює загальній концентрації, яка для води об’ємом 1 л дорівнює: 1000 : 18 = 55,6 (моль/л).
Тоді 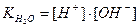 або
або 
Отже, 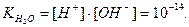
Для води і всіх водних розчинів добуток концентрацій йонів Н+ та ОН-, який має назву йонний добуток води 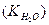 , - величина стала і дорівнює 10-14 при 250С. Значення
, - величина стала і дорівнює 10-14 при 250С. Значення 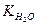 залежить від температури: при 00С
залежить від температури: при 00С 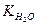 = 0,13.10-14, а при 1000С
= 0,13.10-14, а при 1000С 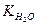 = 74.10-14.
= 74.10-14.
В чистій воді і нейтральних розчинах [H+] = [OH-] = 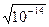 = 10-7 (моль/л).
= 10-7 (моль/л).
Більш зручною характеристикою середовища є так званий водневий показник рН, який дорівнює десятковому логарифму концентрації йонів Гідрогену, взятому з оберненим знаком:
рН = -lg[H+].
Для нейтральних розчинів рН=7, для кислих – рН < 7 і для лужних – рН > 7.
Логарифмуючи йонний добуток води 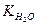 =[H+].[OH-]=10-14, одержуємо lg
=[H+].[OH-]=10-14, одержуємо lg 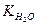 = lg[H+]+lg[OH-] = lg10-14.
= lg[H+]+lg[OH-] = lg10-14.
Змінивши знаки на обернені, маємо -lg 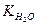 = -lg[H+]-lg[OH-] = -lg10-14. Враховуючи, що -lg[H+] = pH, a –lg[OH-] = рОН, будемо мати: -lg
= -lg[H+]-lg[OH-] = -lg10-14. Враховуючи, що -lg[H+] = pH, a –lg[OH-] = рОН, будемо мати: -lg 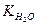 = рН + рОН = -lg10-14 = 14 (при 220С).
= рН + рОН = -lg10-14 = 14 (при 220С).
Якщо –lgK позначити через рК, то вираз буде мати вигляд
рК = рН + рОН = 14.
Активна реакція більшості природних вод є близька до нейтральної (6,8-7,3).
Підземні води іноді мають більш високе значення рН. Кислу реакцію мають рудникові води родовищ, які містять ферум(ІІ) сульфат, болотні води, в яких міститься значна кількість гумусових кислот. Водневий показник морської води змінюється в межах від 8,2 до 8,5.
Величина водневого показника рН характеризує активну кислотність, а величина гідроксидного показника рОН – активну лужність води, тобто концентрацію реально присутніх йонів Гідрогену і гідроксид-йонів.
2. Буферні розчини
Стале значення рН води відіграє важливу роль для нормального перебігу в ній різних фізико-хімічних та біологічних процесів. Незмінність рН природних вод забезпечується присутністю в них буферних систем.
Буферними називають розчини, рН яких не змінюється при додаванні невеликої кількості сильної кислоти або лугу. Буферні розчини містять компоненти, які дисоціюють з утворенням однойменного йону, але відрізняються один від одного ступенем дисоціації.
Основні види буферних розчинів: 1) слабка кислота та її сіль (Н2СО3 + NaHCO3); 2) слабка основа та її сіль (NH4OH і NH4Cl); 3) дві кислі солі (NaH2PO4 і Na2HPO4); 4) кисла та середня сіль (NaHCO3 і Na2CO3).
Сталість рН буферних розчинів при додаванні кислоти або лугу пояснюється зв’язуванням йонів Н+ та ОН- компонентами буферного розчину в малодисоційовані сполуки. Розглянемо це на прикладі карбонатної буферної системи (H2CO3 – Ca(HCO3)2).
Компоненти буферного розчину дисоціюють:
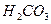 L
L 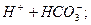
 =
= 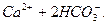
Дисоціація карбонатної кислоти стримується в результаті наявності в розчині великої кількості йонів НСО3-, які утворюються при дисоціації сильного електроліту Са(НСО3)2.
При додаванні йонів Н+ вони будуть з’єднуватись з йонами НСО3-, утворюючи Н2СО3:
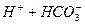 L
L 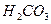 .
.
Концентрацію йонів НСО3- в буферному розчині можна вважати такою, що дорівнює концентрації солі.
Якщо додати до буферного розчину луг, то йони ОН- реагують з йонами Н+, які утворюються при дисоціації Н2СО3. Зменшення концентрації йонів Н+ спричиняє дисоціацію нових порцій Н2СО3. Константа дисоціації карбонатної кислоти за першим ступенем має вигляд
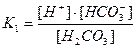 .
.
Концентрацію недисоційованих молекул Н2СО3 можна вважати такою, що дорівнює загальній концентрації кислоти. Тоді
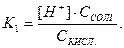
Звідки 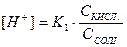 ;
; 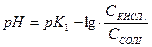 .
.
Отже, рН буферного розчину залежить від співвідношення концентрації кислоти та солі і при розбавленні залишається сталим.
Характеристикою буферних розчинів є величина буферної ємності. Вона визначається числом еквівалентів сильної кислоти або лугу, яке треба додати до 1 л буферного розчину, щоб змінити рН на 1. Максимальна буферна ємність відповідає вмісту компонентів в еквівалентних кількостях.
В поверхневих водах при середніх значеннях рН головною буферною системою є система, яка містить карбонатну кислоту Н2СО3 та гідрогенкарбонати.
Кислі або лужні стоки, які попадають у водойму, в певній кількості можуть бути нейтралізовані цією карбонатною буферною системою.
В лужних водах при рН>8,5 буферні властивості природних вод визначаються іншою карбонатною буферною системою, яка містить гідрогенкарбонати та карбонати (наприклад, NaHCO3 та Na2СО3).
Дата добавления: 2016-05-16; просмотров: 1607;
