Визначення рН за допомогою рН-метра.
У воді рН вимірюють потенціометричним методом за допомогою рН-метра зі скляним електродом. Електродна схема рН-метра показана на рис.3.
Скляний електрод 2 являє собою трубку з напаяною на кінці порожнистою кулькою 1 з літієвого електродного скла.
При зануренні електрода в розчин між поверхнею кульки електрода і розчином відбувається обмін йонами, в результаті якого йони Літію в поверхневих шарах скла заміщуються йонами Гідрогену. Між поверхнею скла і досліджуваним розчином виникає різниця потенціалів, величина якої залежить від концентрації йонів Гідрогену в розчині і його температури. Для вимірювання цієї різниці потенціалів створюють електричний ланцюг. Внутрішній електрод цього ланцюга 3 здійснює контакт з розчином, який заповнює внутрішню частину скляного електрода. Допоміжний електрод 4 являє собою проточний хлор-срібний електрод. Він здійснює контакт з досліджуваним розчином за допомогою електролітичного ключа 6 – трубки, яка закінчується пористою перетинкою і заповнена насиченим розчином калій хлориду. Насичений розчин калій хлориду повинен безперервно повільно витікати в досліджуваний розчин зі швидкістю 20 мл за добу.
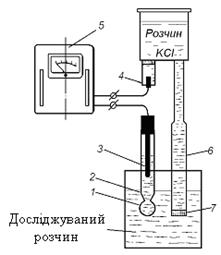
Рис.3. Електродна схема рН-метра
Рівноважний потенціал, який виникає на межі поділу електрод-розчин, лінійно залежить від рН: φ = -0,059 рН.
Відповідно і електрорушійна сила гальванічного елемента, яка виміряна як різниця потенціалів між індикаторним електродом і електродом порівняння, залежить від рН розчину.
Хід вимірювань
1. Перед початком вимірювань прилад включити в мережу і дати нагрітись протягом 20 хвилин.
2. Натиснути клавішу „t” і клавішу будь-якого вузького діапазону рН (-1-4, 4-9, 9-14) і визначити температуру розчину.
3. Електроди промити дистильованою водою і залишок води обережно видалити фільтрувальним папером.
4. Занурити електроди в досліджуваний розчин. Натиснути клавішу рН і клавішу шкали широкого діапазону (-1-14). Виміряти рН приблизно, після цього натиснути клавішу відповідної шкали вузького діапазону і виміряти значення рН з точністю до 0,05.
5. Промити електроди і занурити їх у дистильовану воду.
Запитання для самоконтролю
1. До сильних чи до слабких електролітів належить вода?
2. Які йони утворюються при електролітичній дисоціації води?
3. Чи в усіх природних водах містяться йони Гідрогену?
4. Яка молярна концентрація йонів Гідрогену в нейтральному, кислому та лужному середовищі? Яке значення має рН?
5. Що являє собою йонний добуток води?
6. Як визначають активну кислотність та активну лужність?
ЛАБОРАТОРНА РОБОТА №4.
ВИЗНАЧЕННЯ ЗАГАЛЬНОЇ ЛУЖНОСТІ І КАРБОНАТНОЇ ТВЕРДОСТІ ВОДИ
Теоретичний вступ
Лужність води може бути обумовлена наявністю розчинних основ, середніх і кислих солей, утворених сильними основами і слабкими кислотами (карбонати, сульфіди, гідрогенкарбонати, гідрогенсилікати, гідрогенсульфіди тощо).
Активна лужність характеризується показником рОН.
Лужність визначається нейтралізацією води сильними кислотами.
Звичайно лужність природних вод обумовлена наявністю гідрогенкарбонатів лужних та лужноземельних металів, і значення рН таких вод не перевищує 8,3. Визначення загальної лужності проводиться нейтралізацією проби води сильною кислотою до рН 4,5 в присутності індикатора метилоранжу (інтервал переходу рН становить 3,1-4,4).
Якщо рН>8,3, то визначають вільну лужність. Вона характеризується кількістю сильної кислоти (ммоль-екв/л), необхідної для зниження рН до цього значення (індикатор-фенолфталеїн, інтервал переходу рН становить8,2-10,0). Вільна лужність обумовлена наявністю вільних лугів і розчинених солей – карбонатів, силікатів, сільфідів. Якщо рН<8,3, то вільна лужність дорівнює нулю.
Загальна лужність більшості природних вод обумовлена присутністю тільки гідрогенкарбонат – йонів (НСО3-).
Для переважної більшості природних вод йони НСО3- зв’язані тільки з йонами Са2+ і Mg2+. А гідрогенкарбонати кальцію та магнію зумовлюють карбонатну твердість води. Саме тому, якщо лужність за фенолфталеїном дорівнює нулю, то можна вважати, що загальна лужність води дорівнює її карбонатній твердості.
Дата добавления: 2016-05-16; просмотров: 1989;
