Внутренняя энергия газа. При условиях близких к нормальным (р = 100 кПа, Т = 273 К) молекулы газа можно считать практически не взаимодействующими между собой в том смысле
При условиях близких к нормальным (р = 100 кПа, Т = 273 К) молекулы газа можно считать практически не взаимодействующими между собой в том смысле, что потенциальной энергией их взаимодействия можно пренебречь. Другими словами, чтобы молекулам газа, содержащимся в некотором сосуде, разлететься в разные стороны на неограниченное расстояние друг от друга не требуется тратить энергию.
Это значит, что полная энергия газа равна сумме кинетических энергий составляющих его молекул
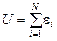 , (10.2)
, (10.2)
где ei – кинетическая энергия i-й молекулы; N – число молекул.
Теоретически доказано, что средняя кинетическая энергия одной молекулы любого одноатомного газа равна
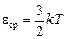 ,
,
где 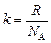 = 1,38×10–23 Дж/К – постоянная Больцмана. (Почему это так, мы выясним позже.)
= 1,38×10–23 Дж/К – постоянная Больцмана. (Почему это так, мы выясним позже.)
Задача 10.1. Чему равна внутренняя энергия n молей одноатомного газа?
Решение. U = N×eср, где N – число молекул, а eср – средняя кинетическая энергия одной молекулы.
N = nNA; 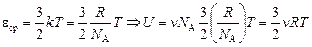 .
.
Ответ: внутренняя энергия n молей одноатомного газа, находящегося при температуре Т, равна
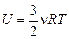 . (10.3)
. (10.3)
Для большинства двухатомных газов в условиях, близких к нормальным, можно считать среднюю кинетическую энергию молекулы равной
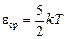 . (10.4)
. (10.4)
Рассуждая аналогично задаче 10.1, можно получить, что внутренняя энергия двухатомного газа в условиях, близких к нормальным, равна
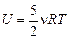 . (10.5)
. (10.5)
СТОП! Решите самостоятельно: В4.
Процесс, происходящий без теплообмена с внешней средой, называется адиабатическим.
Задача 10.2. Газ адиабатически расширяется. Как изменяется температура газа?
Решение. Согласно формуле (10.1) Q = (U2 – U1) + А. По определению адиабатического процесса Q = 0. Поскольку газ расширяется, то А > 0, следовательно, (U2 – U1) = –А < 0.
Ответ: U2 < U1, т.е. внутренняя энергия газа уменьшается, а значит, и температура газа уменьшается.
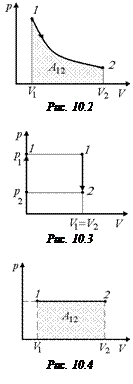
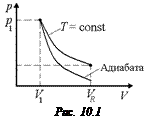 Задача 10.3. Газ, имеющий в начальный момент параметры р1, V1, расширяется: 1) изотермически; 2) адиабатически до объема V2 > V1. Построить графики этих процессов в координатах (р, V).
Задача 10.3. Газ, имеющий в начальный момент параметры р1, V1, расширяется: 1) изотермически; 2) адиабатически до объема V2 > V1. Построить графики этих процессов в координатах (р, V).
Решение. Так как при адиабатическом расширении температура уменьшается, адиабата должна пройти ниже изотермы (см. рис. 10.1).
Ответ: см. рис. 10.1.
СТОП! Решите самостоятельно: В2.
Задача 10.4. Газ изотермически расширяется. Получит ли при этом газ тепло от внешней среды или тепло отдаст?
Решение. Согласно формуле (10.1) Q12 = A12 + (U2 – U1). Если Q12 > 0, значит, газ получит тепло, если Q12< 0, то отдаст тепло.
Как видно из рис. 10.2, А12 > 0. Так как процесс изотермический, то Т = const; следовательно, U = const; U2 – U1 = 0.
 Значит,
Значит,
Q1-2 = A1-2 > 0.
Ответ: газ получит тепло от внешней среды.
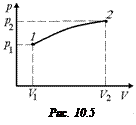
Задача 10.5. Газ изохорически охлаждается (V = const). Получит ли при этом газ тепло от внешней среды или отдаст?
Решение. Нарисуем график процесса в координатах (р, V) (рис. 10.3). Согласно формуле (10.1) Q1-2 = A1-2 + U2 – U1. Как видно из рисунка, А1-2 = 0 (DV = 0).
Поскольку по условию задачи газ охлаждается, то Т2 < Т1, следовательно, U2 < U1, U2 – U1 < 0, отсюда Q1-2 = U2 – U1 < 0.
Ответ: газ отдаст тепло.
Задача 10.6. Газ изобарически расширяется (р = const). Получит ли при этом газ тепло от внешней среды или отдаст?
Решение. Нарисуем график процесса в координатах (р, V) (рис. 10.4). Из графика видно, что А1-2 > 0, Т2 > Т1, значит, U2 > U1. Следовательно,
Q1-2 = А1-2 + (U2 – U1) > 0.
Ответ: газ получит тепло от внешней среды.
Задача 10.7.Газ адиабатически сжимается. Получит ли при этом газ тепло от внешней среды или отдаст?
Решение. Адиабатический процесс проходит (по определению!) в теплоизолированной системе, т.е. газ не получает и не оттает тепла: Q = 0.
Ответ: Q = 0.
СТОП! Решите самостоятельно: А4, В3, В7, С7.
Задача 10.8. Одноатомный газ переходит из состояния с параметрами р1, V1 в состояние с параметрами р2, V2 по закону р = р(V) (рис. 10.5). Найти: 1) работу, совершенную газом; 2) изменение внутренней энергии газа; 3) количество теплоты, полученной газом.
 Решение.
Решение.
1. 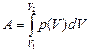 (или площадь под графиком р(V) на участке [V1V2].
(или площадь под графиком р(V) на участке [V1V2].
2. Согласно формуле (10.4)
DU = 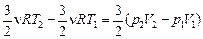 ,
,
поскольку nRT1 = p1V1, nRT2 = p2V2.
3. 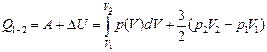 .
.
Ответ: 1) 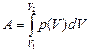 ; 2) DU =
; 2) DU = 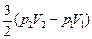 ;
;
3) 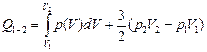 .
.
Запомним формулу:
DU = 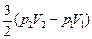 . (10.6)
. (10.6)
Задача 10.9. Одноатомный газ изохорически нагревается, переходя из состояния р0, V0 в состояние 2р0, V0. Найти: 1) работу, совершенную газом; 2) изменение внутренней энергии газа; 3) количество теплоты, полученной газом.
Решение. Построим график в координатах р, V (рис. 10.6).
1. А = 0, так как DV = 0.
2. Согласно формуле (10.6)
DU = 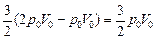 . .
| ||
| р0, 2р0 V0 V = const | 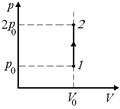 Рис. 10.6
Рис. 10.6
| |
| А = ? DU = ? Q = ? |
3. Согласно формуле (10.1)
Q1-2 = А1-2 + DU = 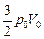 .
.
Ответ: 1) А = 0; 2) 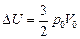 ; 3) Q1-2 =
; 3) Q1-2 = 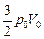 .
.
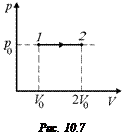
Задача 10.10. Одноатомный газ изобарически расширяется от объема V0 до объема 2V0. Давление р0 = const. Найти: 1) работу газа; 2) изменение внутренней энергии газа; 3) количество теплоты, полученной газом.
| V1 = V0 V2 = 2V0 р0 = const | Решение. Построим график в координатах р, V (рис. 10.7).
1. Так как р0 = const, то
А = р0DV = р0(2V0 – V0) = р0V0.
2. Согласно формуле (10.6)
DU = 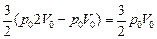 . .
|
| А = ? DU = ? Q = ? | |
 3. Согласно формуле (10.1)
3. Согласно формуле (10.1)
Q = А + DU = А + (U2 – U1) =
= p0V0 + 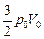 =
=  .
.
Ответ: 1) А = р0V0; 2) DU = 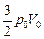 ;
;
3) Q =  .
.
 Замечание. Точки (2р0, V0) и (р0, 2V0) соответствуют одной и той же температуре. В самом деле,
Замечание. Точки (2р0, V0) и (р0, 2V0) соответствуют одной и той же температуре. В самом деле,
(2р0)V0 = р0(2V0), т.е. р1V1 = p2V2,
отсюда Т = const, так как рV = nRT. Значит, в задачах 10.9 и 10.10 газ нагрелся на одну и ту же DТ! Но в первом случае, нагреваясь при постоянном объеме, газ получил только QV = 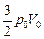 тепла, а во втором случае, нагреваясь при постоянном давлении, газ получил Qp =
тепла, а во втором случае, нагреваясь при постоянном давлении, газ получил Qp =  . То есть
. То есть 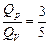 (рис. 10.8). Следовательно, при изобарическом нагревании требуется больше тепла, чем при изохорическом на одну и ту же температуру!
(рис. 10.8). Следовательно, при изобарическом нагревании требуется больше тепла, чем при изохорическом на одну и ту же температуру!
СТОП! Решите самостоятельно: В5, В6, С1.
Задача 10.11. Одноатомный газ изотермически расширяется, переходя из состояния р0, V0 в состояние р0/2, 2V0. Найти: 1) работу, совершенную газом; 2) изменение внутренней энергии газа; 3) количество теплоты, полученной газом.
| р1 = р0 р2 = р0/2 V1 = V0 V2 = 2V0 T = const | 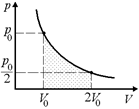 Рис. 10.9
Рис. 10.9
| Решение. Построим график в координатах р, V (рис. 10.9).
Поскольку Т2 = Т1, то и U2 = U1, значит, U2 – U1 = 0.
Поскольку T = const, то по закону Бойля–Мариотта
pV = p1V1, p = 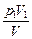 . .
|
| А = ? DU = ? Q = ? |
Вычислим работу газа:
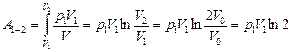 = р0V0ln2.
= р0V0ln2.
Согласно формуле (10.1)
Q = А1-2 + (U2 – U1) = р0V0ln2 + 0 = р0V0ln2.
Ответ: 1) А = р0V0ln2; 2) DU = 0; 3) Q = р0V0ln2.
СТОП! Решите самостоятельно: А6, С2.
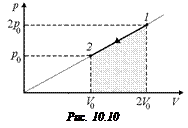 Задача 10.12. Одноатомный газ сжимается по закону р = aV от состояния 2р0, 2V0 до состояния р0, V0 (рис. 10.10). Найти: 1) работу, совершенную газом; 2) изменение внутренней энергии газа; 3) количество теплоты, полученной газом.
Задача 10.12. Одноатомный газ сжимается по закону р = aV от состояния 2р0, 2V0 до состояния р0, V0 (рис. 10.10). Найти: 1) работу, совершенную газом; 2) изменение внутренней энергии газа; 3) количество теплоты, полученной газом.
| р = aV р1 =2р0 р2 = р0 V1 = 2V0 V2 = V0 | Решение. Работа, совершенная газом, равна площади под графиком р(V) на отрезке [V0; 2V0], взятой со знаком «минус»:
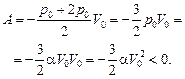 Согласно формуле (10.6)
Согласно формуле (10.6)
|
| А = ? DU = ? Q = ? |
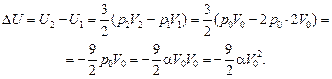
Согласно формуле (10.1)
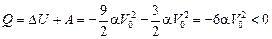 ,
,
т.е. газ отдает тепло.
Ответ: 1)  ; 2)
; 2) 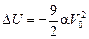 ; 3)
; 3) 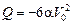 .
.
Задача 10.13. Одноатомный газ переходит из состояния 3р0, V0 в состояние р0, 2V0 (рис. 10.11). Найти: 1) работу, совершенную газом; 2) изменение внутренней энергии газа; 3) количество теплоты, полученной газом.
| р1 =3р0 р2 = р0 V1 = V0 V2 = 2V0 | Рис. 10.11 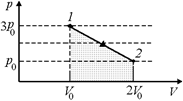 Решение. Работа, совершенная газом, равна площади под графиком р(V) на отрезке [V0; 2V0]:
Решение. Работа, совершенная газом, равна площади под графиком р(V) на отрезке [V0; 2V0]:
|
| А = ? DU = ? Q = ? | |
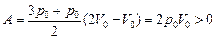 .
.
Согласно формуле (10.6)
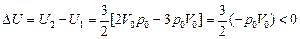 .
.
Согласно формуле (10.1)
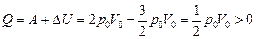 ,
,
т.е. газ получает тепло.
Ответ: 1) 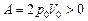 ; 2)
; 2) 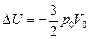 ; 3)
; 3)  .
.
СТОП! Решите самостоятельно: С4, С5.
Дата добавления: 2016-04-11; просмотров: 1386;
