Правило расстановки индексов
1. а) Обратим внимание на знаки: для самопроизвольной реакции (т.е. реакции, идущей в прямом направлении)
 |
Положительный знак ∆ψрцозначает, что работа по перемещению единичного положительногозаряда от электрода 1 к электроду 2 совершалась бы надсистемой (п. 1.4); следовательно, перенос отрицательногозаряда (каковыми являются электроны) происходит в указанном направлении самойсистемой.
б) Отсюда вытекает следующая расстановка индексов в записи
 |
1 — восстановитель(донор электронов),
2 — окислитель(акцептор электронов).
в) Соответственно,
Ψ1 — электрический потенциал катода(–): здесь — избыток электронов;
Ψ2— электрический потенциал анода(+), на котором — дефицит электронов.
 |
2. а) Следовательно, обобщенную ОВР, за счет которой генерируется ЭДС в
гальваническом элементе, следует записать в виде
где фигурируют две окислительно-восстановительные пары (ОВ-пары):
- пара 1 (Ox1/Rd1)— служит в реакции восстановителем и образует катод,
- и пара 2(Ox2/Rd2)— служит окислителеми образует анод.
б) Заметим: в записи отдельной окислительно-восстановительной пары первой указывается окисленная форма.
3. В результате, например, для элемента Даниэля—Якоби (рис. 14.1 и (14.5))
необходимо полагать:
 |
поскольку в происходящей в этом элементе реакции первая из указанных пар
является восстановителем, а вторая — окислителем.
14.8. Зависимость ∆Ψрцот концентраций участников ОВР
И от температуры
1. Зависимость от концентраций.
а) Вспомним уравнение изотермы реакции:
 |
 |
которое определяет зависимость энергии Гиббса от концентраций (активностей) участников. Здесь ΔG°рц – стандартное значение этой энергии; оно соответствует реакции при постоянных одномолярных концентрациях всех реагентов и продуктов. А Па – произведение активностей, которое для обобщённой ОВР вида (14.14) равно:

б) Подставим (8.35,б) в формулу (14.12,б). Тогда получаем уравнение Нернста:
де
u
Здесь 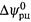 — стандартная ЭДС реакции {стандартный электрический потенциал реакции). Эта величина, как иΔG°рц, соответствует ситуации, когда в полуэлементах поддерживаются одномолярные активности всех участников.
— стандартная ЭДС реакции {стандартный электрический потенциал реакции). Эта величина, как иΔG°рц, соответствует ситуации, когда в полуэлементах поддерживаются одномолярные активности всех участников.
в) Вместе с тем, благодаря соотношению (4.35), стандартная ЭДС реакции просто связана с константой равновесия той же реакции (14.17,в).
г) Итак, уравнение Нернста (14.17,а) устанавливает зависимость ЭДС гальванического элемента от концентраций (активностей) участников ОВР.
Конкретно: чем меньшеПа, тем больше генерируемая ЭДС. Важно отметить, что при этом учитываются активности веществ в обоих полуэлементах.
2. Зависимость от температуры.
а) А здесь воспользуемся формулой (5.13, а)
 |
которая следует из соотношения
 |
при условии, что энтальпия и энтропия реакции практически не зависят от
температуры. Подстановка (14.17,б) дает:
б) Производная  называется температурным коэффициентом ЭДС. Как видно, этот коэффициент полностью определяется энтропией реакции. Отсюда вытекает, что сама зависимость
называется температурным коэффициентом ЭДС. Как видно, этот коэффициент полностью определяется энтропией реакции. Отсюда вытекает, что сама зависимость 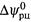 от температуры является линейной.
от температуры является линейной.
 |
в) С другой стороны, измеряя ЭДС гальванического элемента при разных температурах, производную
 можно оценить из экспериментальных данных. Тогда легко найти не только энтропию реакции (исходя из (14.18)), но и энтальпию, т.е. (вместе с энергией Гиббса (14.17,в)) все три термодинамические характеристики соответствующей ОВР. Действительно,
можно оценить из экспериментальных данных. Тогда легко найти не только энтропию реакции (исходя из (14.18)), но и энтальпию, т.е. (вместе с энергией Гиббса (14.17,в)) все три термодинамические характеристики соответствующей ОВР. Действительно,
или
 |
г) Итак, чтобы воспользоваться данной формулой, надо знать производную
стандартной ЭДС по температуре, а также конкретное значение стандартной
ЭДС при какой-либо температуре.
Дата добавления: 2016-03-20; просмотров: 693;
