Підготовка рН-метра або іономіра для проведення виміру
1. Прогрівають 15 мінут.
2. Калібрують по стандартних буферних розчинах. Поміщають електродну систему в стандартний буферний розчин із рн = 1,1. Виставляють це значення на приладі. Електроди промивають дистильованою водою. Поміщають електродну систему в стандартний буферний розчин із рн = 9,18. Виставляють це значення на приладі. Електроди промивають дистильованою водою. Цю процедуру повторюють кілька разів, поки на приладі мимовільно не буде потрібного значення рн.
3. Власний вимір.
Лекція 7. Кулонометричний метод аналізу
План лекції
1. Теоретичні основи метода.
2. Кулонометричне титрування на прикладі йод-йодидного тирування з біамперометричною точкою фіксації точки еквівалентності.
1. Кулонометричний метод аналізу базується на процесах електролізу. Кількісно процеси електролізу визначаються законами Фарадея:
1) маса електроліту 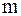 , що піддається перетворенню при електролізі, а також маси речовин, що виділяються на електродах, прямо пропорційні кількості електрики
, що піддається перетворенню при електролізі, а також маси речовин, що виділяються на електродах, прямо пропорційні кількості електрики 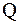 , що пройшла через розчин чи розплав електроліту:
, що пройшла через розчин чи розплав електроліту:
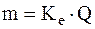 ,
,
де 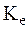 – електрохімічний еквівалент, що дорівнює масі речовини, яка виділилася при протіканні одиниці кількості електрики, г/Кл;
– електрохімічний еквівалент, що дорівнює масі речовини, яка виділилася при протіканні одиниці кількості електрики, г/Кл;
2) при пропусканні однакової кількості електричного струму крізь розчини або розплави різних електролітів маси речовин, які виділилися на електродах, пропорційні їх хімічним еквівалентам Е:
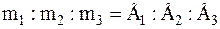 .
.
Обидва закони поєднують загальною формулою:
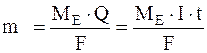 ,
,
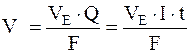 ,
,
де m, V – маса чи об’єм речовини, що зазнає перетворення на електродах (виділяється чи розкладається); ME – молярна маса еквівалентів речовини, г/моль; 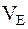 – об’єм 1 моль еквівалента речовини; I – сила струму, А; t – час, с; F – стала Фарадея.
– об’єм 1 моль еквівалента речовини; I – сила струму, А; t – час, с; F – стала Фарадея.
Для виділення 1 моль еквівалента будь-якої речовини потрібно 96485 кулонів. Ця величина називається сталою Фарадея.
2. Кулонометричне титруваннябазується на електрохімічній організації титранта безпосередньо в розчині з речовиною, що титрують. Така генерація титранта дозволяє скасувати операції дозування титранта в розчин, що титрується з бюретки. Сутність методу: паралельно з електрохімічною реакцією, що протікає під дією електричного струму, у розчині відбувається також хімічна реакція між обумовленою речовиною й продуктом електрохімічної реакції. Електроліз ведуть у розчині, що містить великий надлишок сторонніх іонів, які також здатні до електрохімічного перетворення; таким прийомом усувають небажані побічні реакції, головна з яких –розкладання води.
Розглянемо кулонометричне йод-йодидне біамперометричне титрування тіосульфату натрію. Схема комірки для кулонометричного титрування:
 Г+ – основний генераторний електрод (нержавіюча сталь); Г– – допоміжний генераторний електрод (нержавіюча сталь); U– – основний індикаторний катод (скловуглець); U+ – допоміжний індикаторний електрод (ніхромовий дріт); мкА – мікроамперметр індикаторного
Г+ – основний генераторний електрод (нержавіюча сталь); Г– – допоміжний генераторний електрод (нержавіюча сталь); U– – основний індикаторний катод (скловуглець); U+ – допоміжний індикаторний електрод (ніхромовий дріт); мкА – мікроамперметр індикаторного
ланцюга; мА – міліамперметр контролю генераторного струму; R – регулятор завдання генераторного струму.
Проведення йодометричного титрування.
Титрат – тіосульфат натрію, титрант – йод. Досліджуваний розчин відновника (Na2S2О3) уводять у розчин калій йодиду (фоновий розчин), у який поміщають чотирьох електродну комірку. Включають одночасно секундомір і струм у генераторному ланцюзі. На генераторному аноді продукується титрант за реакцією: 2I–– 2e = I2 або, з огляду на комплексоутворення:
2I– + КI – 2e = КI3.
На генераторному катоді відбувається виділення водню при розкладанні води (електроліз): 2НОН + 2е = Н2 + 2ОН–.
Молекулярний йод, що утвориться, хімічно реагує з титратом за законом еквівалентів. А кількість йоду, що утвориться на генераторному аноді, можна визначити за законом Фарадея: 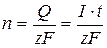 , де n – кількість йоду (моль); Q – кількість електрики, що прошла через розчин, дорівнює добутку сили струму (I,А) на час (t, сек.); z – число електронів, що беруть участь в елементарному акті електрохімічної реакції; F – стала Фарадея (96485 Кл/моль). Для тіосульфату z = 1. Доти, поки в розчині існує відновник (титрат), йод, що утвориться в результаті генерації моментально реагує з ним, тому в індикаторному ланцюзі струм практично не йде. Після того, як весь титрат прореагує, йод з'являється в розчині.
, де n – кількість йоду (моль); Q – кількість електрики, що прошла через розчин, дорівнює добутку сили струму (I,А) на час (t, сек.); z – число електронів, що беруть участь в елементарному акті електрохімічної реакції; F – стала Фарадея (96485 Кл/моль). Для тіосульфату z = 1. Доти, поки в розчині існує відновник (титрат), йод, що утвориться в результаті генерації моментально реагує з ним, тому в індикаторному ланцюзі струм практично не йде. Після того, як весь титрат прореагує, йод з'являється в розчині.
Із цього моменту на індикаторному катоді (скловуглець) піде реакція:
I2 +2e=2 I-I– або КI3+2e= КI + 2 I-I–.
При цьому мікроамперметр почне показувати зміну струму й у цей момент необхідно зупинити секундомір. Поява струму в індикаторному ланцюзі свідчить про досягнення точки еквівалентності. На індикаторному аноді відбувається розчинення ніхромового дроту. При несвоєчасному вимиканні пристрою, робочий розчин може бути перетитрован (надлишок титранту).
Способи багаторазового проведення титрування в розчині: 1) підкислення робочого розчину до рН = 4-5; 2) усунення йоду шляхом адсорбції вугіллям; 3) ізоляція розчину поблизу генераторного катода, на якому відбувається залуження.
Точність методу – 2 %. Обумовлені абсолютні кількості речовин у звичайних установках 10–6-10–5 моль-еквівалентів. Біамперометричний – метод індикації двома електродами. Кулонометричний аналіз завдяки своїй високій чутливості й простоті використовується для аналізу мікроконцентрацій речовин у стічних водах, в оборотних промислових водах, для контролю атмосфери та ін.
Переваги
| |
Дата добавления: 2016-03-20; просмотров: 752;
