Лекція 8. Вольтамперометрія і мас-спектрометрія
План лекції
1. Теоретичні основи метода вольтамперометрії, якісний та кількісний аналіз, застосування.
2. Мас-спектрометрія: теоретичні основи методу, прилади та застосування.
1. Вольтамперометрія –сукупність електрохімічних методів дослідження та аналізу, заснованих на вивченні залежності сили струму в електролітичних комірках від потенціалу зануреного в аналізований розчин індикаторного мікроелектрода, на якому реагує досліджувана електрохімічно активна (електроактивна) речовина. У комірку поміщають крім індикаторного допоміжний електрод зі значно більшою поверхнею, щоб при проходженні струму його потенціал практично не змінювався. Різниця потенціалів індикаторного і допоміжного електродів Е описується рівнянням Е = U - IR, де U – поляризуюча напруга, R– опір розчину.
В дослідний розчин вводять у великій концентрації індиферентний електроліт (фон), щоб зменшити величину R і виключити міграційний струм, що викликається дією електричного поля на електроактивні речовини. При низьких концентраціях цих речовин омічне падіння напруги IR в розчині дуже мале. Для повної компенсації омічного падіння напруги застосовують потенціостатування і трьохелектродні комірки, що містять додатково електрод порівняння. У цих умовах 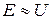 . В якості індикаторних мікроелектродів використовують стаціонарні – з металу (ртуть, срібло, золото, платина), вуглецевих матеріалів (графіт), капаючі електроди (з ртуті, амальгам, галію). Останні являють собою капіляри, з яких по краплях капає рідкий метал. З використанням капаючіх електродів, потенціал яких змінюється повільно і лінійно, метод аналізу називається полярографією (Я. Гейровский, 1922 р.). Електроди порівняння – електроди другого роду (каломельний, хлоридсрібний).
. В якості індикаторних мікроелектродів використовують стаціонарні – з металу (ртуть, срібло, золото, платина), вуглецевих матеріалів (графіт), капаючі електроди (з ртуті, амальгам, галію). Останні являють собою капіляри, з яких по краплях капає рідкий метал. З використанням капаючіх електродів, потенціал яких змінюється повільно і лінійно, метод аналізу називається полярографією (Я. Гейровский, 1922 р.). Електроди порівняння – електроди другого роду (каломельний, хлоридсрібний).
Криві залежності I = f(E) або I = f(U) (вольтамперограми) реєструють спеціальними приладами – полярографами різних конструкцій.
Ділянка збільшення струму називається хвилею. Хвилі – анодні, якщо електроактивна речовина окиснюється, або катодні, якщо вона відновлюється. Коли в розчині присутні окислена (Ох) і відновлена (Red) форми речовини, досить швидко (оборотно) реагують на мікроелектроді, на вольтамперограмі спостерігається безперервна катодно-анодна хвиля, яка перетинає осі абсцис при потенціалі, відповідному окисно-відновному потенціалу системи Ox/Red в цьому середовищі. Якщо електрохімічна реакція на мікроелектроді повільна (необоротна), на вольтамперограмі спостерігаються анодна хвиля окиснення відновленої форми речовини і катодна хвиля відновлення окисленої форми (більш негативний потенціал). Утворення майданчика граничного струму на вольтамперограмі пов'язано з обмеженою швидкістю масопереносу електроактивної речовини до поверхні електрода шляхом конвективної дифузії (граничний дифузійний струм, Id) або з обмеженою швидкістю утворення електроактивного речовини з обумовленого компонента в розчині. Такий струм називають граничним кінетичним, а його сила пропорційна концентрації цього компонента. Форма хвилі для конвертованої електрохімічної реакції описується рівнянням:  , де R – газова стала, Т– абсолютна температура, E1/2 – потенціал напівхвилі, тобто потенціал, відповідний половині висоти хвилі (Id/2). Значення E1/2 характерно для даної електроактивної речовини і використовується для її ідентифікації (якісний аналіз).
, де R – газова стала, Т– абсолютна температура, E1/2 – потенціал напівхвилі, тобто потенціал, відповідний половині висоти хвилі (Id/2). Значення E1/2 характерно для даної електроактивної речовини і використовується для її ідентифікації (якісний аналіз).
Коли електрохімічній реакції передує адсорбція дослідної речовини на поверхні електрода, на вольтамперограмах спостерігаються не хвилі, а піки, що пов'язано з екстремальної залежністю адсорбції від потенціалу електрода. На вольтамперограмах, зареєстрованих у лінійній зміні (розгортці) потенціалу зі стаціонарним електродом або на одній краплі електрода, спостерігаються піки, низхідна крива яких визначається збіднінням приелектродного шару розчину електроактивною речовиною. Висота піку при цьому пропорційна концентрації електроактивної речовини. У полярографії граничний дифузійний струм (мкА), усереднений з часу життя краплі, описується рівнянням Ільковича:

 де n – число електронів, що беруть участь в електрохімічній реакції, С –концентрація електроактивної речовини (ммоль), D – коефіцієнт дифузії (см2/с),
де n – число електронів, що беруть участь в електрохімічній реакції, С –концентрація електроактивної речовини (ммоль), D – коефіцієнт дифузії (см2/с),  – час життя ртутної краплі (с), m – швидкість витікання ртуті (мг/с).
– час життя ртутної краплі (с), m – швидкість витікання ртуті (мг/с).
Рис.15. Вольтамперограмма, що отримується за допомогою обертового дискового електрода.
Циклічна вольтамперометрія (зі швидкою трикутною розгорткою потенціалу) дозволяє вивчати кінетику та механізм електродних процесів шляхом спостереження на екрані осцилографічної трубки. Нижня межа обумовлених концентрацій в методах вольамперометрії з лінійної розгорткою потенціалу становить 10-5-10-6 моль/л. Для її зниження до 10-7-10-8 моль/л використовують вдосконалені інструментальні варіанти – змінно-струмову і диференціальну імпульсну вольтамперометрію. Висота піку на вольтамперометричній хвилі пропорційна концентрації електроактивної речовини, а потенціал піку служить для ідентифікації цієї речовини за довідковими даними. Піки на змінно-струмових вольтамперограмах відображають не тільки електрохімічні реакції електроактивних речовин, але і процеси адсорбції – десорбції неектроактивних речовин на поверхні електрода.
У інверсійній вольтамперометрії з попередній накопиченням досягає 10-9-10-11 моль/л. Мінімальне значення С отримують, використовуючи тонкоплівкові ртутні індикаторні електроди, у тому числі ртутно-графітові, що складаються з дрібних крапельок ртуті, електролітично виділених на підкладку з спеціально обробленої графіту. Для фазового і елементного аналізу твердих тіл використовують інверсіонну вольтамперометрію з електроактивними вугільними електродами (мінерально-вугільними пастовими електродами). Їх готують із суміші вугільного порошку, досліджуваного порошкоподібної речовини та інертного сполучного, наприклад вазелінового масла. Розроблено варіант цього методу, який дає можливість проводити аналіз і визначати товщину металевих покриттів. У цьому випадку використовують спец. пристрій, що дозволяє реєструвати вольтамперограму, користуючись краплею фонового електроліту, нанесеного на дослідну поверхню.
Вольтамперометрію застосовують:для кількісного аналізу неорганічних і органічних речовин в дуже широкому інтервалі концентрацій від 10-10% до десятків %; для дослідження кінетики і механізму електродних процесів, включаючи стадію перенесення електронів, адсорбцію вихідних продуктів; для вивчення будови подвійного електричного шару, рівноваги комплексоутворення в розчині, утворення і дисоціації інтерметалевих сполук ртуті і на поверхні твердих електродів; для вибору умов ампераметричного титрування.
2. Мас-спектрометрія –один з найбільш ефективних експресних методів аналізу й установлення будови як індивідуальних органічних сполук, так і синтетичних, природних сполук та їхніх сумішей. Завдяки своїй винятково високій чутливості й можливості використання в комбінації з газовою й рідинною хроматографією метод широко застосовується в органічній, біоорганічній, біологічній, фізичній, аналітичній, медичній хімії (експресний метод газового аналізу), у нафтохімії, фармакології, токсикології, охороні навколишнього середовища, судово-медичній експертизі, у контролі виробництва. Одним зі способів встановлення будови досліджуваної сполуки цим методом є автоматичне порівняння зареєстрованого спектра з банком спектрів, уведених до пам’яті ЕОМ. Це можна здійснити тільки в тому випадку, якщо в даному банку є спектр саме цієї речовини. Даний спосіб не придатний для встановлення будови зовсім нових, синтезованих або виділених із природних джерел, сполук. Останнім часом робляться спроби використати ЕОМ для автоматичної інтерпретації спектрів по спеціальних програмах, в основу яких покладені загальні й специфічні закономірності фрагментації органічних сполук.
Мас-спектроскопія – метод дослідження речовини шляхом визначення мас іонів цієї речовини (частіше відношення мас іонів до їхніх зарядів) і їхніх кількостей. Сукупність значень мас й їхніх відносних вмістів (концентрацій) називається мас-спектром (рис16).
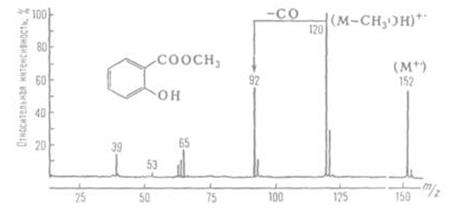
Рис. 16. Мас-спектр метилсаліцилату
У мас-спектроскопії використовується поділ у вакуумі іонів різних мас під впливом електричних і магнітних полів. Досліджувана речовина насамперед піддається процесу іонізації. Процес іонізації виключається при вивченні іонної структури вже іонізованих газів. У випадку рідких і твердих речовин їх або попередньо випаровують, а потім іонізують, або ж застосовують поверхневу іонізацію. Спочатку мас-спектроскопію застосовували переважно для визначення ізотопного складу елементів і точного виміру їх атомних мас. Варіації ізотопного складу елементів можуть бути визначені з відносною похибкою ±10–2 %, а маси ядер – з відносною похибкою ±10–5 % для легких й ±10-4 % для важких елементів. Висока точність і чутливість мас-спектрометрії як методу ізотопного аналізу призвели до її застосування у ядерній техніці. У геології й геохімії мас-спектральне визначення ізотопного складу ряду елементів (свинцю, аргону) лежить в основі методів визначення віку гірських порід і рудних утворень. Мас-спектрометрія широко використовується в хімії для елементного й молекулярного структурного аналізу. Якісний молекулярний мас-спектральний аналіз сумішей заснований на тім, що мас-спектри молекул різної будови різні, а кількісний – на тім, що іонні струми від компонентів суміші пропорційні вмістам цих компонентів. Молекулярний структурний мас-спектральний аналіз заснований на тім, що при іонізації речовини деяка частина молекул перетворюється на іони, не руйнуючись, а деяка частина при цьому розпадається на фрагменти. Вимір мас і відносного змісту молекулярних й осколкових іонів (молекулярного мас-спектра) надає інформацію не тільки про молекулярну масу, але й про структуру молекули. У фізико-хімічних дослідженнях мас-спектрометрію застосовують при дослідженнях процесів іонізації, фізичної й хімічної кінетики; визначення потенціалів іонізації, теплоти випаровування, енергій зв'язку атомів у молекулах. Висока абсолютна чутливість мас-спектрометрії дозволяє використати її для аналізу дуже невеликої кількості речовини (10-12 г). Прилади (DELTAPlus, DELTA Plus XL і МАТ253) здатні визначити різницю в 1 ізотоп серед 10 млн. атомів.
Для вимірювання питомого заряду (відношення заряду частинки до її маси: 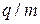 ) використовують відхилення заряджених частинок у магнітному та електричному полях. Для детектування іонів використовують фотопластинки та детектори іонів. Теорія молекулярного структурного мас-спектрального аналізу при найбільш часто використовуваному методі іонізації електронним ударом (електрони з енергією у кілька разів більшою за енергію іонізації) заснована на уявленні про утворення при такому ударі збудженого молекулярного іона, що розпадається потім з розривом більш слабких зв'язків у молекулі. Стан теорії не дає поки можливості кількісно передбачати мас-спектр молекули й необхідні для кількісного аналізу коефіцієнт чутливості приладу для різних речовин. Тому для визначення невідомої структури молекули по її мас-спектру й для якісного аналізу використовують кореляційні дані по мас-спектрах речовин різних класів, а для грубої оцінки коефіцієнта чутливості – практично лінійний зв'язок між сумарною ймовірністю іонізації й молекулярною масою для не надто важких молекул одного гомологічного ряду. При молекулярному мас-спектральному аналізі, якщо можливо, завжди проводять градуювання приладу по відомих речовинах або сумішам відомої сполуки (при визначенні ізотопної суміші, внаслідок відносно малої різниці в ймовірностях іонізації або дисоціації порівнюваних часток, аналіз іноді можливий без градуювання по сумішах відомої сполуки). В наш час для аналізу результатів та їх інтерпретації використовують комп’ютерну техніку, що дозволяє аналізувати та прораховувати одержані дані.
) використовують відхилення заряджених частинок у магнітному та електричному полях. Для детектування іонів використовують фотопластинки та детектори іонів. Теорія молекулярного структурного мас-спектрального аналізу при найбільш часто використовуваному методі іонізації електронним ударом (електрони з енергією у кілька разів більшою за енергію іонізації) заснована на уявленні про утворення при такому ударі збудженого молекулярного іона, що розпадається потім з розривом більш слабких зв'язків у молекулі. Стан теорії не дає поки можливості кількісно передбачати мас-спектр молекули й необхідні для кількісного аналізу коефіцієнт чутливості приладу для різних речовин. Тому для визначення невідомої структури молекули по її мас-спектру й для якісного аналізу використовують кореляційні дані по мас-спектрах речовин різних класів, а для грубої оцінки коефіцієнта чутливості – практично лінійний зв'язок між сумарною ймовірністю іонізації й молекулярною масою для не надто важких молекул одного гомологічного ряду. При молекулярному мас-спектральному аналізі, якщо можливо, завжди проводять градуювання приладу по відомих речовинах або сумішам відомої сполуки (при визначенні ізотопної суміші, внаслідок відносно малої різниці в ймовірностях іонізації або дисоціації порівнюваних часток, аналіз іноді можливий без градуювання по сумішах відомої сполуки). В наш час для аналізу результатів та їх інтерпретації використовують комп’ютерну техніку, що дозволяє аналізувати та прораховувати одержані дані.
 Мас-спектрометри – прилади для розділу іонізованих частинок речовини (молекул, атомів) по їхніх масах, заснований на впливі магнітних й електричних полів на пучки іонів, що летять у вакуумі (рис.17). У мас-спектрометрії реєстрація іонів здійснюється електричними методами, у мас-спектрографах – по потемнінню чутливого шару фотопластинки, що поміщається в прилад.
Мас-спектрометри – прилади для розділу іонізованих частинок речовини (молекул, атомів) по їхніх масах, заснований на впливі магнітних й електричних полів на пучки іонів, що летять у вакуумі (рис.17). У мас-спектрометрії реєстрація іонів здійснюється електричними методами, у мас-спектрографах – по потемнінню чутливого шару фотопластинки, що поміщається в прилад.

а) введення проби шлюзова камера
а анод катод – +
в
вакуум 10-6 – 10-7 мм. рт. ст.
S N
m1 m2 m3
ф.е.
б) <<
Рис. 17. Блок-схема (а) і
схема (б) мас-спектрометра
.
Мас-спектрометр містить пристрій для підготовки досліджуваної речовини, іонне джерело, де ця речовина частково іонізується й відбувається формування іонного пучка, мас-аналізатор, у якому відбувається поділ іонів по масах, точніше, по величині відношення маси іона до його заряду; приймач іонів, де іонний струм перетвориться в електричний сигнал, що потім підсилюється й реєструється. У пристрій, що реєструє, крім інформації про кількість іонів (іонний струм), з аналізатора надходить інформація про масу іонів. Мас-спектрометр містить також системи електричного живлення й пристрій відкачки, що створює і підтримує високий вакуум в джерелі й аналізаторі. При будь-якому способі реєстрації іонів мас-спектр в остаточному підсумку являє собою залежність величини іонного струму I від m. Висота кожного піка пропорційна вмісту даного ізотопу. Відношення маси іона до ширини піка (в одиницях маси)називається роздільною силою або роздільною здатністю мас-спектрометра. Для повної характеристики роздільної здатності приладу необхідно знати форму іонного піка, що залежить від багатьох факторів. Іноді роздільною здатністю називають значення тієї найбільшої маси, при якій два піки, що відрізняються по масі на 1, можна виявити. Якщо досліджувана речовина вводиться в іонне джерело у вигляді газу, то чутливістю часто називають відношення струму, створюваного іонами даної маси заданої речовини, до парціального тиску цієї речовини в іонному джерелі. Ця величина в приладах різних типів і з різними роздільними здатностями лежить у діапазоні 10-6-10-3 А/мм рт. ст. Відносною чутливістю називається мінімальний вміст речовини, що ще може бути виявлений за допомогою мас-спектрометрії у суміші речовин. Для різних приладів, сумішей і речовин вона лежить у діапазоні 10-3-10-7 %. Абсолютна чутливість – мінімальна кількість речовини в грамах, яку необхідно ввести для виявлення даної речовини.
В основі класифікації мас-спектрометрів – принцип будови і функціонування мас-аналізатора. Розрізняють статичні й динамічні мас-аналізатори. У статичних мас-аналізаторах для поділу іонів використовують електричні й магнітні поля, постійні або практично не змінні за час прольоту іона через прилад. Поділ іонів в цьому випадку просторовим: іони з різними значеннями m/е рухаються в аналізаторі по різних траєкторіях. У мас-спектрографах пучки іонів з різними величинами m/е фокусуються в різних місцях фотопластинки, утворюючи після проявлення сліди у вигляді смужок. У статичних мас-аналізаторах пучок іонів із заданим m/е фокусується на щілину приймача іонів. Мас-спектр утворюється при зміні магнітного або електричного поля, у результаті чого в прийомну щілину послідовно попадають пучки іонів з різними величинами m/е. При безперервному записі іонного струму виходить графік з іонними піками (рис. 16).
Мас-спектрометри класифікуються за способами іонізації: 1) іонізація електронним ударом; 2) фотоіонізація; 3) іонізація в сильному електричному полі (польова іонна емісія), 4) іонізація іонним ударом (іонно-іонна емісія); 5) поверхнева іонізація, електрична іскра у вакуумі (вакуумна іскра); 6) іонізація під дією лазерного променя.
В аналітичній мас-спектроскопії найбільш часто застосовуються завдяки відносній технічній простоті й досить сильним іонним струмам способи: 1 – при аналізі речовин, що випаровують; 6 – при роботі із нелеткими речовинами й 5 – при ізотопному аналізі речовин з низькими потенціалами іонізації. Значення середніх іонних струмів, створюваних іонним джерелом з іонізацією електронним ударом при енергії іонів в 40-100 еВ і ширині щілини джерела кілька десятків мкм, становлять 10-10-10-9 А. Для інших способів іонізації ці струми менші. «М'яка» іонізація (незначна дисоціація іонів) здійснюється за допомогою електронів, енергія яких лише на 1-3 еВ перевершує енергію іонізації молекули, а також з використанням способів 2, 3, 4. Одержувані при «м'якій» іонізації струми 10-12-10-14 А.
Чутливість підсилювачів 10-15-10-14 А при постійній часу 0,1-10 сек. Підвищення чутливості або швидкодії досягається застосуванням електронних помножувачів, які підвищують чутливість виміру струмів до 10-18-10-19 А.
Приблизно ті ж значення чутливості досягаються при використанні фотографічної реєстрації іонів. Через малу точність виміру іонних струмів і громіздкості пристроїв введення фотопластинок у вакуумну камеру аналізатора, фотореєстрація мас-спектрів зберегла значення лише при дуже точних вимірах мас, у випадках, коли необхідно одночасно реєструвати всі лінії мас-спектра через нестабільність джерела іонів.
Прийнята система індексів для мас-спектрометрів класифікує прилади за призначенням. Індекс із 2 букв (МІ – мас-спектрометр ізотопний, МХ – для хімічного аналізу, МС – для фізико-хімічних (структурних досліджень), МВ – прилад з високою роздільною здатністю) і 4 цифр, з яких перша вказує на використаний метод поділу іонів по масах (1 – у магнітному однорідному полі, 2 – у магнітному неоднорідному, 4 – магніто-динамічний, 5 – час-пролітний, 6 –радіочастотний), друга – на умови застосування (1 – індикатори, 2 – для виробництв, контролю, 3 – лабораторних досліджень, 4 – спеціальних умов), а останні дві є номером моделі.
Дата добавления: 2016-03-20; просмотров: 1813;
