Лекція 3. Аналіз за спектрами випромінювання
План лекції
1. Характеристика полум'яної фотометрії.
2. Метод атомно-абсорбційного аналізу.
3. Люмінесцентний аналіз.
1. Полум'яна фотометрія – розділ атомно-емісійного спектрального аналізу. Основа методу – збудження в полум'ї спектру визначеного елемента та вимірювання інтенсивності світіння аналітичної лінії. Джерело випромінювання – полум'я. Розчин, що аналізується за допомогою розпилювача переводять в аерозоль і подають в полум'я пальника. Під дією високої температури випаровується розчинник, видаляється кристалізаційна вода, випаровуються тверді залишки, молекули яких розпадаються на атоми і, збуджуючись, випромінюють спектри. В полум’ї можливий аналіз не тільки рідких, а й твердих проб. Термічна енергія високотемпературного полум’я нижча енергії дуги або іскри. Тому в полум'ї збуджується тільки найбільш чутливі спектральні лінії з низьким потенціалом збудження. Число елементів, визначених цим методом, значно менше, ніж при збуджені електричним джерелом світла.
В полум'яному фотометрі будь-якого типу розрізняють три основні частини: системи збудження, виділення аналітичної спектральної лінії і системи реєстрування інтенсивності випромінювання лінії. Система збудження спектральних ліній складається з розпилювача і розпилювальної камери, полум’я і пальника. Паливом для пальника слугують горючі гази і газ-окислювач (пропано-бутанова або киснево-ацетиленова суміш).
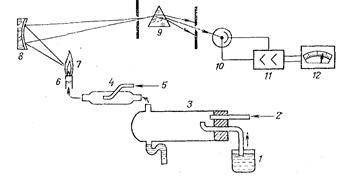
Рис.3 Схема полум’яного фотометра:
1 – дослідний розчин; 2 – подача газа-окислювача; 3 – розпилювач; 4 –відстійник-змішувач; 5 – подача газа-палива; 6 – пальник; 7 – полум’я; 8 –дзеркало-конденсатор; 9 – монохроматор; 10 – фотоелемент; 11, 12 – підсилювач і звітно-реєструючий прилад.
Система виділення спектральної лінії складаються з світофільтрів і спектральних пристроїв – монохроматорів. Реєструючі системи об’єднують всі способи виявлення і реєстрації інтенсивності випромінювання спектральної лінії (фотоелементи, реєструючи пристрої). Пальники двох типів: не розпилюючі (ламінарні) і розпилюючі (турбулентні). Не розпилюючі пальники мають зовнішню розпилюючю систему. Утворені в ній аерозолі разом з газом-окислювачем подаються в конденсаційну камеру-змішувач, де змішуються з гарячим газом і потім подаються в полум’я пальника. Для стабілізування режиму горіння таких пальників необхідно збільшити швидкість стікання газів із сопла пальника. В пальниках турбулентного типу дослідний розчин втягується газом-окислювачем в капіляр і потім розпилюється в реакційну зону полум’я. В полум’ї розчинник випаровується, сіль розкладається, при цьому випромінюються електромагнітні хвилі певної довжини. За світлофільтром 9 проводять якісний аналіз, кожна речовина випромінює світло певної довжини хвилі. За допомогою фотоелемента і гальванометра проводять кількісний аналіз. Застосовується розрахунок за стандартом.
Переваги методу:можливо визначити 70 елементів з табл. Д.І. Менделєєва; для аналізу лужних металів використовують низько температурне полум’я (пропано-бутанова суміш) до 1500˚С; використовують в медицині для проведення аналізу Na, K, Ca в крові.
Недоліки методу: трудомісткість, потрібні газові суміші, небезпезпека у роботі з балонами.
2. Метод атомно-абсорбційного аналізу (AAA) заснований на резонансному поглинанні світла вільними атомами, що виникає при пропущенні пучка світла через шар атомного пара. Селективно поглинаючи світло на частоті резонансного переходу, атоми переходять з основного стану в збуджений, а інтенсивність проходить пучка світла на цій частоті експоненціально зменшується за законом Бугера-Ламберта.
При практичних вимірах зазвичай користуються значенням оптичної густини поглинання. У кількісному хімічному аналізі необхідно встановити зв'язок між коефіцієнтом поглинання і концентрацією атомів в поглинаючому шарі. У сучасній техніці атомно-абсорбційного аналізу використовуються два способи атомізації: атомізація в полум'ї і електричних атомізаторах.
Атомізація в полум'ї.Для отримання полум'я використовують різні комбінації горючих газів з окислювачами (водню, пропану або ацетилену з повітрям або оксидом нітрогену). Кисень в чистому вигляді майже не застосовують як окислювач, так як суміші горючих газів з ним мають дуже високу швидкість горіння, важко піддаються контролю. У практиці ААА найбільш застосовуються повітряно-ацетиленові суміші та полум'я оксиду нітрогену з ацетиленом. Ці дві газові суміші взаємно доповнюють один одного і спільно дозволяють визначати приблизно 70 елементів. Повітряно-пропанове полум'я придатне переважно для визначення лужних металів; кадмію, міді, свинцю, срібла і цинку. Утворення вільних атомів в полум'ї є наслідком великої сукупності процесів: отримання аерозолю з розчину дослідної проби; випаровування розчинника з крапельок аерозолю; випаровування твердих частинок аерозолю і дисоціація молекул на атоми; процеси збудження та йонізації атомів, утворення нових сполук в результаті реакцій з радикалами, аніонами, атомами Оксигену і Карбону, наявними в полум'ї.
Обмеження методу обумовлені іншими реакціями в полум'ї і малою тривалістю перебування частинок в ньому (10-3 с). Полум'я небезпечне в роботі і потребує витрат досить великих обсягів газоподібного пального і окислювача. Більш дешевими, безпечними і ефективними у багатьох відношеннях виявилися електротермічні атомізатори.
Атомізація в електротермічних атомізаторах. Дослідну пробу у вигляді розчину дозують мікропіпеткою в кількості 5-100 мкл через центральний отвір на стінку холодної печі, кінці якої закріплені всередині масивних графітових контактів. Піч постійно обдувається потоком аргону, що оберігає її від обгорання і сприяє видаленню випаровуваємої проби з атомізатора. Після висушування проба випаровується до атомів, і атомний пар заповнює всю трубку. Температура графітової печі регулюється спеціальним електронним пристроям з програмним управлінням. Зазвичай температурну програму за часом можна розділити на 3 етапи: висушування проби (випаровування ра-створітеля), озолення (піроліз органічних компонентів і видалення деяких інших компонентів матриці), атомізація, тобто власне випаровування і перехід визначається елемента в стан атомного пара. Кожному етапу відповідає своя оптимальна температура. Необхідність в такій ступінчастою температурної програмі пов'язана з тим, що на стадіях висушування і озолення часто спостерігається інший сигнал абсорбції, обумовлений розсіюванням зондуючого випромінювання димом, частинками золи.
Атомізація проби в графітовійї печі в залежності від фізико-хімічних особливостей елементів, що визначаються і матриць проби може відбуватися:
• проба спочатку випаровується з нагрітої поверхні атомизатора, потім дисоціює на елементи в газовій фазі;
• проба спочатку термічно дисоціює до відповідних оксидів, які потім відновлюються до металу, або вуглецем до твердофазної реакції на межі поверхонь: МО + С = М + СО або оксидом Карбону (ІІ) МО + СО = М + СО2.
ААА з застосуванням електротермічного атомізатора забезпечує рекордно низькі межі виявлення по багатьом елементам (від десятих до десятитисячних часток нанограма в 1 мм розчину проби, досягаючи іноді значення 10–12-10–4 г. Для вимірювання атомної абсорбції застосовують однопроменеві і двопроменеві атомно-абсорбційні спектрофотометри.
3. Люмінесценція(лат. lumen – світло і escent – суфікс, що означає слабку дію) – надлишок над тепловим випромінюванням тіла, тривалість якого перевищує період світлових коливань (приблизно 10-10с і більше). Люмінесценція здатна проявлятися при нижчих температурах, не використовує теплову енергію випромінюючої системи («холодне світіння»). Критерій тривалості, введений Вавіловим, дозволяє відрізнити люмінесценцію від інших видів нетеплового випромінювання: розсіювання і відбивання світла. Тривалість їх менше періоду коливання світлової хвилі (<10-10 с). Раніше поняття «люмінесценція» відносили тільки до випромінювання видимого світла, сьогодні воно застосовується до випромінювання у ближньому УФ та ІК діапазонах. Фізична природа люмінесценції – випромінювальні переходи електронів зі збудженого стану у стійкий стан. Люмінофори – речовини, що здатні до світіння. Люмінесцентний метод аналізу заснований на здатності речовин випромінювати електромагнітні хвилі певної довжини під дією різноманітних факторів. Довготривала люмінесценція – фосфоресценція, короткотривала – флуоресценція(піко секунди-мілісекунди); за механізмом: резонансна, спонтанна, вимушена, рекомбінаційна; за типом збудження: фотолюмінесценція, кріо-, рентгено- (дія рентгенівських променів), катодо- (збудження електронним пучком), хемі-(в результаті хімічних реакцій); електро-(електричним полем); трібо- (механічними деформаціями), радіо- (проникаючою радіацією), йоно-(прискореними йонами), альфа-люмінесценція (збудження альфа-частинками).
Фосфоресценція виникає внаслідок опромінення речовини світлом, йонізуючим промінням, проходження крізь неї електричного струму, при хімічних реакціях, механічному впливі; пов'язана з існуванням в кристалі таких електронних станів, з яких можливі тільки заборонені оптичні переходи, які характеризуються великим часом життя. Флуоресценція (флюоресценція)виникає внаслідок опромінення речовини світлом, йонізуючим промінням, проходження крізь неї електричного струму, при хімічних реакціях, механічному впливі.
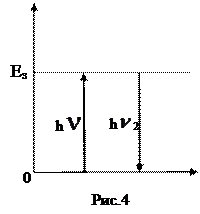 Фотолюмінесце́нція – світіння, яке виникає під дією світлових променів видимих і УФ частот (жорстке УФ випромінювання 200 нм). Фотозбудження застосовується для отримання люмінесценції рідких кристалів, скла, твердих порошків (кристалофосфорів), воно зручне для об'єктів з малими і середніми концентраціями люмінесцентної активної речовини. За значних концентрацій активаторів або в розчинах з поглинаючим розчинником воно збуджує тільки поверхневі шари речовини. Щільність УФ і видимих потоків випромінювання в сучасних джерелах збудження люмінесценції відносно невелика. Тому для фотолюмінесценції характерні середні і малі яскравості. Світло рідко використовується для збудження газів, оскільки щільність поглинаючих центрів незначна і при відносно малих потужностях фотозбудження інтенсивність люмінесценції слабка. Найпоширеніша – фотолюмінесценція. Окрім традиційних ефектів поглинання, відбивання та заломлення світла для цього методу характерні також резонансний ефект, флуоресценція і фосфоресценція. Резонансний ефект(резонансна флуоресценція) спостерігається в атомних парах (ртуті, натрію) у деяких простих молекул та в більш складних системах. Випромінювання має спонтанний характер, відбувається з того самого енергетичного рівня, який досягається при поглинанні енергії збуджуючого світла. При збільшенні щільності парів резонансна люмінесценція переходить у резонансне розсіювання.
Фотолюмінесце́нція – світіння, яке виникає під дією світлових променів видимих і УФ частот (жорстке УФ випромінювання 200 нм). Фотозбудження застосовується для отримання люмінесценції рідких кристалів, скла, твердих порошків (кристалофосфорів), воно зручне для об'єктів з малими і середніми концентраціями люмінесцентної активної речовини. За значних концентрацій активаторів або в розчинах з поглинаючим розчинником воно збуджує тільки поверхневі шари речовини. Щільність УФ і видимих потоків випромінювання в сучасних джерелах збудження люмінесценції відносно невелика. Тому для фотолюмінесценції характерні середні і малі яскравості. Світло рідко використовується для збудження газів, оскільки щільність поглинаючих центрів незначна і при відносно малих потужностях фотозбудження інтенсивність люмінесценції слабка. Найпоширеніша – фотолюмінесценція. Окрім традиційних ефектів поглинання, відбивання та заломлення світла для цього методу характерні також резонансний ефект, флуоресценція і фосфоресценція. Резонансний ефект(резонансна флуоресценція) спостерігається в атомних парах (ртуті, натрію) у деяких простих молекул та в більш складних системах. Випромінювання має спонтанний характер, відбувається з того самого енергетичного рівня, який досягається при поглинанні енергії збуджуючого світла. При збільшенні щільності парів резонансна люмінесценція переходить у резонансне розсіювання.
Під дією кванта світла (h 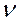 1) молекула переходить у збуджений стан, який характеризується енергією збудження (Езб). У цьому стані молекула перебуває нетривалий час, після закінчення якого повертається у свій стійкий стан, випромінюючи квант світла (h
1) молекула переходить у збуджений стан, який характеризується енергією збудження (Езб). У цьому стані молекула перебуває нетривалий час, після закінчення якого повертається у свій стійкий стан, випромінюючи квант світла (h 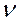 2). (рис. 4). Процес повернення молекули зі збудженого стану в стійкий з випромінюванням кванта світла називається дезактивацією. h
2). (рис. 4). Процес повернення молекули зі збудженого стану в стійкий з випромінюванням кванта світла називається дезактивацією. h  1= h
1= h  2.
2.
Флуоресценція(від назви мінералу флюорит, у якого вперше була виявлена флуоресценція) – короткочасна (10-8-10-9 с), характерна для рідин і розчинів.
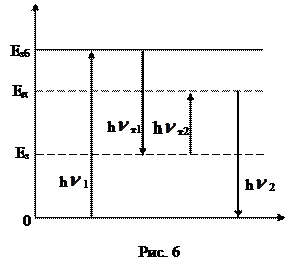
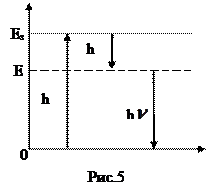 Під дією кванта світла (h
Під дією кванта світла (h 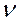 1) молекула переходить у збуджений стан, який характеризується енергією збудження (Езб). При зіткненні зі сторонніми частинками молекула втрачає частину енергії у вигляді теплового кванта (h
1) молекула переходить у збуджений стан, який характеризується енергією збудження (Езб). При зіткненні зі сторонніми частинками молекула втрачає частину енергії у вигляді теплового кванта (h 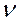 т) і переходить на більш низький дозволений енергетичний рівень (Ед), з якого можлива дезактивація. При поверненні молекули у стійкий стан випромінюється квант світла (h
т) і переходить на більш низький дозволений енергетичний рівень (Ед), з якого можлива дезактивація. При поверненні молекули у стійкий стан випромінюється квант світла (h 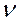 2). (рис.5). В цьому випадку h
2). (рис.5). В цьому випадку h 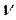 1> h
1> h 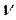 2. Фосфоресценція триває значний час після припинення збудження, характерна для твердих речовин. Кристали, які здатні люмінесцирувати, – кристалофосфори. Під дією кванта світла (h
2. Фосфоресценція триває значний час після припинення збудження, характерна для твердих речовин. Кристали, які здатні люмінесцирувати, – кристалофосфори. Під дією кванта світла (h 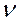 1) молекула переходить у збуджений стан, який характеризується енергією збудження (Езб). При зіткненні зі сторонніми частинками молекула втрачає частину енергії у вигляді теплового кванта (h
1) молекула переходить у збуджений стан, який характеризується енергією збудження (Езб). При зіткненні зі сторонніми частинками молекула втрачає частину енергії у вигляді теплового кванта (h 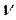 т1) і переходить на заборонений енергетичний рівень (Ез), з якого неможлива дезактивація. На цьому рівні молекула перебуває досить тривалий час, доки не отримає додатковий квант (h
т1) і переходить на заборонений енергетичний рівень (Ез), з якого неможлива дезактивація. На цьому рівні молекула перебуває досить тривалий час, доки не отримає додатковий квант (h 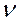 т2) при зіткненні зі сторонніми частинками, який переводить її на дозволений енергетичний рівень (Ед). При дезактивації випромі-нюється квант світла (h
т2) при зіткненні зі сторонніми частинками, який переводить її на дозволений енергетичний рівень (Ед). При дезактивації випромі-нюється квант світла (h 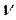 2). (рис.6).
2). (рис.6).
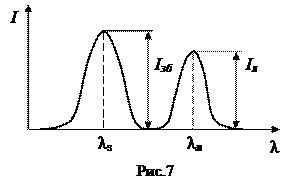 Ефективність перетворення енергії поглиненого світла в енергію люмінесценції характеризується енергетичним і квантовим виходами. Відношення випромінюваної енергії люмінесценції (Ел) до енергії поглиненого світла (Ес) – енергетичний вихід люмінесценції (Вен):
Ефективність перетворення енергії поглиненого світла в енергію люмінесценції характеризується енергетичним і квантовим виходами. Відношення випромінюваної енергії люмінесценції (Ел) до енергії поглиненого світла (Ес) – енергетичний вихід люмінесценції (Вен): 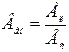 , а відношення числа випромінюваних квантів (Nл) до числа поглинених (Nс) – квантовий вихід люмінесценції (
, а відношення числа випромінюваних квантів (Nл) до числа поглинених (Nс) – квантовий вихід люмінесценції ( 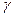 ):
): 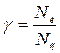 . Якщо прийняти
. Якщо прийняти 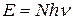 , то
, то 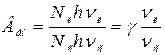 .
.
Спектральна характеристика (рис. 7) – залежність випромінювання від довжини хвилі.
Якщо λзб, λл – положення максимуму відповідно лінії збудження та лінії люмінесценції, а Iзб та Iл – відповідноінтенсивність збудження і люмінесценції, то квантовий вихід люмінесценції буде мати вигляд: 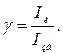
 Чим більший квантовий вихід, тим інтенсивніша люмінесценція, і тим менша кількість люмінесцируючої речовини може бути визначена за її світінням. Як правило
Чим більший квантовий вихід, тим інтенсивніша люмінесценція, і тим менша кількість люмінесцируючої речовини може бути визначена за її світінням. Як правило 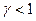 . Це пов‘язано з процесами гасіння люмінесценції. Лінійна залежність інтенсивності люмінесценції від концентрації буде зберігатися при сталості квантового виходу, інтенсивності збуджуючого світла і ін. Суттєва умова – низька концентрація речовини. Під дією різноманітних факторів можливе відхилення від лінійності (рис.8), що зменшує квантовий вихід.
. Це пов‘язано з процесами гасіння люмінесценції. Лінійна залежність інтенсивності люмінесценції від концентрації буде зберігатися при сталості квантового виходу, інтенсивності збуджуючого світла і ін. Суттєва умова – низька концентрація речовини. Під дією різноманітних факторів можливе відхилення від лінійності (рис.8), що зменшує квантовий вихід.
Види гасіння: – концентраційне (при великих концентраціях збільшення інтенсивності світіння непропорційне збільшенню концентрації); –температурне (з підвищенням температури від 60°С і більше зменшується вихід світіння). Вавілов С. розрізняв гасіння I і II роду. I рід гасіння пов‘язаний з процесами внутрішньо-молекулярних переходів, які можуть проявлятися як у збудженому, так і в незбудженому стані. Гасіння I роду не пов‘язане зі зміною тривалості світіння, а пов‘язане з переходом нелюмінесцируючої речовини у люмінесцируючу і навпаки. Гасіння II роду не пов‘язане з внутрішньо-молекулярними переходами, а супроводжується впливом зовнішніх факторів (температура, тиск, хімічні речовини, хімічні реакції). Негативний вплив на вихід люмінесценції чинять домішки. Гасіння люмінесценції лежить в основі деяких методик визначення домішок.
Дуже чутливими є люмінесцентні якісні реакції, коли додавання деяких органічних реагентів до розчину неорганічних речовин викликає яскраву люмінесценцію (додавання саліцилової кислоти до розчину солі цинку). Якісний люмінесцентний аналіз заснований на здатності досліджуваної речовини у відповідних умовах люмінесцирувати або гасити люмінесценцію. Виникнення або зникнення люмінесценції зазвичай спостерігається візуально. Перевагою люмінесцентних реакцій є їх винятково низька межа визначення. Також низьку межу визначення і селективність мають так звані реакції отримання кристалофосфорів (реакція утворення перлів бури і фосфатів).
Кількісний люмінесцентний аналіззаснований на використанні співвідношення, яке зв‘язує інтенсивність флуоресценції з концентрацією флуоресцируючої речовини. В межах концентрації речовин 10-4-10-6 г/мл залежність інтенсивності від концентрації прямолінійна. Кількісні виміри у флуориметрії засновані на використанні стандартних розчинів речовин (спосіб порівняння або калібрувального графіку). Якщо в якості розчину порівняння застосовується стандартний розчин речовини, то концентрацію досліджуваного розчину (Сх) розраховують за формулою: 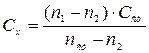 , де n1, n2, nст – відповідно показання флуориметру для досліджуваного розчину; контрольного розчину; стандартного розчину; Сст – концентрація стандартного розчину.
, де n1, n2, nст – відповідно показання флуориметру для досліджуваного розчину; контрольного розчину; стандартного розчину; Сст – концентрація стандартного розчину.
 Люмінесцентні індикатори (
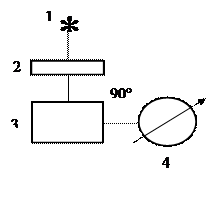
Люмінесцентні індикатори ( 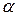 -нафтіламін, акрідін) змінюють колір або інтенсивність люмінесценції в залежності від властивостей учасників реакції, pH розчину або присутності окисника. Їх застосування дозволило вирішити ряд складних аналітичних задач, пов‘язаних з аналізом мутних і забарвлених середовищ (фруктові соки, вина). Збільшується інтенсивність люмінесценції при заморожуванні розчинів, органічних речовин і комплексів металів з органічними лігандами. Для вивчення люмінесценції широко застосовують методи спектрофотометрії. На цих методах засновуються не тільки вимірювання спектрів люмінесценції, а й визначення виходу люмінесценції. Для дослідження люмінесценції велике значення має вимірювання релаксаційних характеристик, наприклад, загасання люмінесценції. Для вимірювання короткого часу загасання (10-8-10-9 с), застосовують флуориметри, різноманітні імпульсні методи. Вивчення релаксації тривалої люмінесценції, наприклад, кристалофосфорів, проводиться за допомогою фосфороскопів і тауметрів. Щоб спектри збудження і спектри світіння не накладалися один на одного, спостереження проводять під кутом 90°. Найпростіша схема спостереження аналогічна нефелометрії (рис. 9).
-нафтіламін, акрідін) змінюють колір або інтенсивність люмінесценції в залежності від властивостей учасників реакції, pH розчину або присутності окисника. Їх застосування дозволило вирішити ряд складних аналітичних задач, пов‘язаних з аналізом мутних і забарвлених середовищ (фруктові соки, вина). Збільшується інтенсивність люмінесценції при заморожуванні розчинів, органічних речовин і комплексів металів з органічними лігандами. Для вивчення люмінесценції широко застосовують методи спектрофотометрії. На цих методах засновуються не тільки вимірювання спектрів люмінесценції, а й визначення виходу люмінесценції. Для дослідження люмінесценції велике значення має вимірювання релаксаційних характеристик, наприклад, загасання люмінесценції. Для вимірювання короткого часу загасання (10-8-10-9 с), застосовують флуориметри, різноманітні імпульсні методи. Вивчення релаксації тривалої люмінесценції, наприклад, кристалофосфорів, проводиться за допомогою фосфороскопів і тауметрів. Щоб спектри збудження і спектри світіння не накладалися один на одного, спостереження проводять під кутом 90°. Найпростіша схема спостереження аналогічна нефелометрії (рис. 9).
Рис.9. Схема спостереження люмінесценції: 1 – джерело випромінювання; 2 – первинний світлофільтр; 3 – кювета; 4 – реєстратор.
Схема флуориметра представлена на рис. 10. Світло від джерела випромінювання (ртутно-кварцева лампа) проходить через первинний світлофільтр 1 (увіолеве скло) 2 і падає на кювету 3 з досліджуваним розчином. Приймач світла 5 вимірює люмінесцентне випромінювання під прямим кутом до напряму збуджуючого світла. Вторинний світлофільтр 4 пропускає світло люмінесценції та поглинає розсіяне світло від джерела збудження.

1 – ртутно-кварцева лампа; 2 – первинний світлофільтр; 3 – кювета; 4 – вторинний світлофільтр; 5 – діафрагма; 6 – фотоелемент; 7 – посилювач; 8 – гальванометр.
Досліджувану речовину освітлюють жорсткими УФ променями (200 нм). Найбільше розповсюдження серед різноманітних джерел випромінювання, які викликають люмінесценцію, отримали газоразрядні лампи (ртутно-кварцеві і ксенонові). Реєстратором може бути око людини, в сучасних пристроях в якості приймача випромінювання використовують фотопомножувачі.
Переваги методу:
– можливість визначення майже всіх елементів, багатьох органічних, біологічно активних та інших речовин (твердих, рідких), вивчення сумішей та визначення мікродомішок;
– різноманітні галузі застосування аналізу (ядерна фізика, рентгеноскопія, фармакологія, вітамінологія, біохімія, криміналістика, сільське господарство, харчова промисловість); створення люмінесцентних фарб, люмінесцентних джерел випромінювання з високим ККД, для кінозйомки, дефектоскопії та електронних приладів; люмінесценція деяких речовин лежить в основі роботи лазерів;
– можливість визначення 10-4 мг/л речовини.
Недолік методу – обмежений концентраційний діапазон визначення через гасіння люмінесценції.
Дата добавления: 2016-03-20; просмотров: 2026;
