Аналіз за спектрами поглинання
1. Інструментальні методи хімічного аналізу – розділ аналітичної хімії, що вивчає методи визначення хімічного складу речовин. Дисципліна тісно пов'язана з різними галузями хімічної науки і виробництва, її методами користуються у геології, металургії, медицині, біохімії, фізиці тощо. У металургії, наприклад, неможливо виплавляти сталь без контролю за вмістом у ній Карбону, Сульфуру, Фосфору та інших елементів.
У сільському господарстві необхідні аналіз грунту, кормів, впровадження у практику більш досконалих методів хімічного аналізу щодо впливу добрив на родючість грунтів, застосування засобів захисту рослин тощо. Велике значення має хімічний аналіз для розв'язання проблем охорони навколишнього середовища. Розвиток медицини тісно пов'язаний із виявленням і кількісним визначенням окремих хімічних елементів у складі тканин живих організмів, сучасні методи аналітичного дослідження застосовуються і в криміналістиці.
Особливо велике значення інструментальних методів хімічного аналізу для наукового обгрунтування і розробки сучасних методів автоматичного контролю, без яких неможливо підтримувати на оптимальному рівні хіміко-технологічні і хіміко-фізичні процеси виробництва.
Важливим завданням дисципліни є знаходження чіткої залежності між складом і властивостями речовин, кількісного вираження цієї залежності, створення простих і надійних засобів та приладів вимірювання всіх методів аналізу, оцінки їх метрологічних характеристик, виявлення об'єктів, в аналізі яких ці методи можуть бути застосовані.
Важливим є точність аналізу, бо від цього залежить наукова істина.
Інструментальні методи дослідження тісно пов'язані з різними галузями хімічної науки, виробництв, тобто людського сьогодення. Досягнення хіміків дають можливість розвиватись все новим методам досліджень.
Інструментальні методи хімічного аналізу засновані на вимірюванні за допомогою приладів певних фізичних властивостей системи, які є функцією кількості компоненту, який визначають в пробі, що аналізують.
Інструментальні методи мають ряд переваг у порівнянні з класичними методами: мають значно вищу чутливість, селективність, експресність, об’єктивність, можливість автоматизації і комп’ютеризацій процесу аналізу.
Чутливість – здатність методу виявляти найменші розходження між двома вимірами.
Селективність – здатність визначення компонентів серед інших. Визначається за впливом домішок. Виділяють селективність відносну (на групу речовин) і абсолютну – на одну конкретну речовину.
Відтворюваність– ступінь відповідності повторних дослідів в одному ж матеріалі. Кількісно оцінюють відтворюваність за зворотному показнику – розкиду. Статистичний аналіз розкиду – середнє статистичне відхилення, залежить від випадкових помилок.
Правильність – відповідність середнього практичного значення якійсь належній величині (теоретичне значення). Залежить від систематичних помилок. Статистичний критерій правильності – міра відхилення середньо арифметичного значення від належної величини.
Інструментальні методи хімічного аналізу можна поділити на декілька груп. Найважливіші з яких: оптичні; електрохімічні; хроматографічні методи.
2. До оптичного діапазону відносяться електромагнітні хвилі з довжиною від 100 до 10000 нм. Його розділяють на три області: ультрафіолетову (УФ) 100-380 нм; видиму 380-760 нм; інфрачервону (ІЧ) 760-10000 нм.
В залежності від характеру взаємодії речовини з електромагнітним випромінюванням оптичні методи розділяють на: абсорбційні (засновані на вимірюванні поглинання речовиною світлового випромінювання). До них відносять колориметрію, фотоколориметрію, спектрофотометрію, атомно-адсорбційні методи; емісійні (засновані на вимірюванні інтенсивності світла, випромінюваного речовиною), флюориметрію, емісійний спектральний аналіз та полум’яну фотометрію. Методи, повязані із взаємодією світлового випромінювання з суспензіями, поділяють на: турбідиметрію (заснована на вимірюванні інтенсивності світла, яке поглинається незабарвленою суспензією); нефелометрію ( заснована на вимірюванні інтенсивності світла, яке відбивається або розсіюється забарвленою або незабарвленою суспензією). Нефелометрію застосовують для кількісного визначення речовини, що утворюють з певними реагентами достатньо стійку суспензію. Тоді вимірюють інтенсивність світла, відбитого часточками цієї суспензії.
Методи, засновані на явищі поляризації молекул під дією світлового випромінювання ділять на: рефрактометрію (заснована на вимірюванні показника заломлення); поляриметрію (заснована на вимірюванні кута обертання плоскості поляризації поляризованого променя світла, що пройшов через оптично активне середовище).
Оптичні методи аналізу нерозривно повязані з використанням сучасних приладів різної складності, що породжує вартість аналізу, але дає ряд переваг у порівнянні з класичними хімічними методами: експресність, нерушійність зразків, простоту методики, використання невеликої кількості речовини для аналізу, можливість аналізувати сполуки будь-якої можливість аналізувати сполуки будь-якої природи проведення експрес аналізу багато компонентних сумішей. Крім того, вони підвищують чутливість, точність і відтворюваність результатів кількісних визначень.
3. Фотометричні методи аналізуґрунтуються на вимірюванні поглинання, пропускання та розсіювання світла досліджуваною речовиною. В основі цих методів лежать в основному хімічні реакції утворення або руйнування забарвлення сполук. Деякі безбарвні або слабко забарвлені йони при взаємодії з іншими йонами чи органічними реагентами утворюють слабко забарвлені сполуки. Це кольорові реакції (йони Феруму(III), що мають світло-жовте забарвлення, під час взаємодії з тіоціанат-іонами утворюють комплексні сполуки забарвлені в червоний колір). При цьому кількість утвореного продукту реакції пропорційна інтенсивності забарвлення. Головним у фотометричному аналізі є хімічна реакція, яка відбувається між досліджуваним йоном та реагентом і від вибору якої залежать ефективність, чутливість і точність методу. Важливим є спосіб вимірювання інтенсивності забарвлення утвореної сполуки. Фотометрію застосовують для визначення вмісту малих кількостей досліджуваної речовини в розчині, які не можна визначити гравітаційним та об’ємним методами.
Колориметрія – метод кількісного аналізу, що ґрунтується на візуальному порівнянні інтенсивності забарвлення розчину досліджуваної речовини з розчином відомої концентрації цієї самої речовини. Розчин з точно відомою концентрацією, який застосовується для порівняння, називають стандартним або еталонним розчином. У методі аналізу фотоелектроколориметріїінтенсивність забарвлення досліджуваних розчинів вимірюють за допомогою фотоелетроколориметрів.
Оптичні методи аналізу ґрунтуються на взаємодії речовини з електромагнітним випромінюванням, що характеризується довжиною хвилі λ, відповідною енергією Е і частотою випромінювання υ. Характеристика спектру електромагнітного випромінювання і процесів, що відбуваються в результаті поглинання чи випромінювання світла речовиною, наведено нижче.
| Спектральна ділянка | Довжина хвилі λ,нм | Енергія Е,еВ | Процеси, що відбуваються внаслідок поглинання світла |
| Ультрафіолетова: вакуумна ближня | 100-200 | — | Електронні переходи |
| 200-380 | 100-10 | ||
| Видима | 380-760 | 10-1 | |
| Інфрачервона: ближня дальня | 760-1500 | 1-0,01 | Коливання молекул |
| 1,5х10³-1000000 | 1-0,01 | Обертання молекул |
Для збудження обертальних і коливальних рівнів молекули достатньо найменшої енергії випромінювання дальньої ІЧ ділянки спектра. Збудження ж електронних рівнів молекули відбувається під дією видимої та УФ ділянки спектра, за рахунок випромінювання з енергією 100-10 еВ. Зміна електронних рівнів молекули супроводжується зміною її коливальної й обертальної енергії, тому при поглинанні молекулою УФ випромінювання високої енергії спектр поглинання складається з широких смуг. Практично спектр поглинання, що відображає графічну залежність величини поглинання від довжини хвилі, можна дістати, якщо на шляху електромагнітного випромінювання помістити речовину, що поглинає промені певних довжин хвиль.
При проходженні монохроматичного пучка світла з інтенсивністю I0 крізь забарвлений розчин певна частина світла (ІВ) відбивається, інша (ІП) – поглинається, а решта (І) – проходить крізь шар розчину: I0 = ІВ + ІП + І .
Світловий потік при проходженні крізь розчин втрачає частину своєї інтенсивності. Вчені П.Бугер і І.Ламберт встановили, що здатність розчину поглинати світло певної довжини залежить від товщини шару l і визначається за формулою: 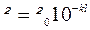 ,де k – коефіцієнт поглинання, який є сталою величиною для певного розчину. Відношення
,де k – коефіцієнт поглинання, який є сталою величиною для певного розчину. Відношення 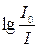 називають оптичною густиною розчину і позначають літерою D.
називають оптичною густиною розчину і позначають літерою D.
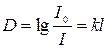 – математичний вираз закону Бугера-Ламберта.
– математичний вираз закону Бугера-Ламберта.
У 1862 р. А.Бер встановив зв'язок між інтенсивністю потоку світла і концентрацією речовини, тобто, поглинання світла прямо пропорційне кількості частинок (концентрації) речовини, крізь яку проходить світло. Закон Бугера-Ламберта-Бера – основний закон поглинання світла розчинами. В інтегральній формі:  . Після логарифмування: D=
. Після логарифмування: D= 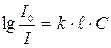 , де k – коефіцієнт пропорційності; С – концентрація розчину; l- товщина шару розчину. Коефіцієнт пропорційності k – показник поглинання розчину з концентрацією і товщиною шару, що дорівнює одиниці, є характерним фізико-хімічним параметром для кожної забарвленої речовини. Якщо концентрація розчиненої речовини становить 1 моль/дм³, то показник поглинання розчину k за товщиною шару розчину, що дорівнює 1 см, називається молярним коефіцієнтом поглинання і позначають ε. Він є мірою здатності речовини вбирати світло певної довжини хвилі, залежить від природи речовини і температури, дає можливість оцінити чутливість фотометричних методів, його обчислюють за результатами вимірювання оптичної густини розчину за даної довжини хвилі:
, де k – коефіцієнт пропорційності; С – концентрація розчину; l- товщина шару розчину. Коефіцієнт пропорційності k – показник поглинання розчину з концентрацією і товщиною шару, що дорівнює одиниці, є характерним фізико-хімічним параметром для кожної забарвленої речовини. Якщо концентрація розчиненої речовини становить 1 моль/дм³, то показник поглинання розчину k за товщиною шару розчину, що дорівнює 1 см, називається молярним коефіцієнтом поглинання і позначають ε. Він є мірою здатності речовини вбирати світло певної довжини хвилі, залежить від природи речовини і температури, дає можливість оцінити чутливість фотометричних методів, його обчислюють за результатами вимірювання оптичної густини розчину за даної довжини хвилі:  . Оптичну густину розчину з масовою часткою розчиненої речовини, що дорівнює 1% за товщини шару розчину 1 см, називають питомим коефіцієнтом поглинання і позначають
. Оптичну густину розчину з масовою часткою розчиненої речовини, що дорівнює 1% за товщини шару розчину 1 см, називають питомим коефіцієнтом поглинання і позначають 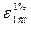 ; його обчислюють:
; його обчислюють:  , де ω – масова частка розчиненої речовини, %.
, де ω – масова частка розчиненої речовини, %.
Оптична густина розчину залежить від концентрації речовини, її природи і товщини шару розчину, крізь який проходить світло. Графічна залежність оптичної густини від концентрації виражається прямою лінією, що проходить через початок координат (калібрувальний графік). Відхилення від лінійності: фізичні (тільки в розведених розчинах з молярною концентрацією менш 0,01 моль/л, при великих концентраціях збільшується кількість молекул барвника і утворюються асоціати, на межі повітря-скло 4% світла, що падає, відбивається, немонохроматичний світловий потік); хімічні (утворення кристалогідратів, сольватів, комплексів, гідроліз, рН).
Щоб мати спектральну характеристику забарвленої речовини, потрібно одержати експериментально спектр поглинання, що є графічною залежністю оптичної густини D від довжини хвилі λ. Спектрограма є індивідуальною характеристикою речовини, що поглинає світло, її використовують для якісного аналізу та визначення кількісного вмісту її в розчині. За спектром поглинання можна вибрати оптимальну довжину хвилі для аналітичного визначення речовини, причому найбільша чутливість відповідає максимуму світло поглинання. Смуга поглинання характеризується параметрами: максимумом поглинання, довжиною хвилі, що відповідає максимуму поглинання і ефективною шириною смуги 2 σ.
 Рис.1 Електронний спектр поглинання
Рис.1 Електронний спектр поглинання
Важливим чинником у фотометрії, що впливає на чутливість визначення оптичної густини розчину, є правильний вибір світлофільтра. Світлофільтр вибирають так, щоб його максимум пропускання збігався зі спектральною ділянкою максимального поглинання променів забарвленим розчином (світлофільтр повинен максимально пропускати тільки ту ділянку спектра, яка поглинається розчином досліджуваної речовини).
Відношення інтенсивності потоку випромінювання, що пройшов крізь досліджуваний розчин, до інтенсивності початкового потоку випромінювання називають прозорістю (пропусканням) і позначають Т: 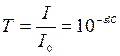 .
.
Пропускання – частина падаючого світла, що пройшло крізь розчин. Оптична густина і пропускання пов’язані: 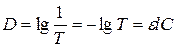 .
.
Якщо пропускання виразити у відсотках: 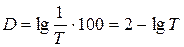 .
.
Для речовини за однакової оптичної густини розчинів їх концентрації обернено пропорційні товщині шару розчинів, що поглинають світло: 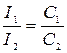 .
.
Вимоги до кольорових реакцій:1) забарвлення сполуки має відбуватися швидко; 2) одержана сполука повинна мати сталий склад і достатньо інтенсивне забарвлення; 3) забарвлення має бути стійким і не руйнуватися під дією світла; 4) інтенсивність забарвлення розчину має підпорядковуватися закону Бугера-Ламберта-Бера.
Дата добавления: 2016-03-20; просмотров: 1846;
