Лекція 2. Аналіз за спектрами поглинання
План лекції
1. Прилади і техніка виконання фотометричного аналізу.
2. УФ-спектрофотометрія і ІЧ-спектрофотометрія.
3. Характеристика нефелометричного методу аналізу.
1. Правила приготування забарвлених розчинів:
1. До стандартного і досліджуваного розчинів добавляють однакові реактиви в тій самій послідовності і в однакових кількостях.
2. Забарвлені розчини, як стандартний, так і досліджуваний, готують одночасно.
3. Об’єми стандартного й досліджуваного розчинів мають бути однаковими.
4. Забарвлення досліджуваного й стандартного розчинів порівнюють за однакових умов.
Залежно від способу вимірювання інтенсивності поглинання світла забарвленими сполуками фотометричний аналіз поділяють на дві групи: візуальні (колориметричні) та фотоелектроколориметричні.
У колориметрії порівняння інтенсивності забарвлення стандартного та досліджуваного розчинів здійснюють шляхом зміни концентрації (методи стандартних серій, розбавляння та колориметричного титрування), товщини шару розчинів (метод зрівнювання) або інтенсивності світлового потоку (метод діафрагм). Візуальну колориметрію нині практично не використовують, вона має лише теоретичне та історичне значення.
Фотоелектроколориметричні методи дають можливість виміряти інтенсивність поглинання світла за допомогою спеціальних приладів – фотоелектроколориметрів (ФЕК) або спектрофотометрів (СФ). Усі ФЕКі складаються з освітлювача, світлофільтрів, систем регулювання опорів, мікроамперметра. У комплекс також входить набір спеціальних кювет.
Принцип вимірювання світлопоглинання забарвлених розчинів за допомогою таких приладів полягає в тому, що потік світла, який проходить крізь кювету з розчином або розчинником, потрапляє на фотоелемент і перетворюється на електричну енергію, що вимірюється.
Принцип роботи фотоелектроколориметра можна розглянути на прикладі КФК-2. Він призначений для вимірювання коефіцієнтів пропускання і оптичної густини довжин хвиль від 315 до 980 нм та визначення на підставі цих даних концентрацій речовин у розчинах. Пучок світла від лампи 1 проходить крізь конденсор 2, діафрагму 3, об’єктиви 4,5 і світлофільтри 6,7,8. Кювету 10 з досліджуваним розчином вводять у світловий потік між захисними стеклами 9,11. Пластина 13 розподіляє світловий потік на два потоки: один потрапляє на фотодіод 12, другий – на фотоелемент 14.
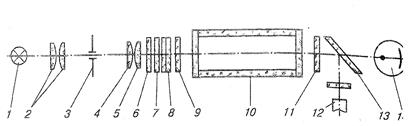
Фотоприймачі працюють у різних ділянках спектра: фотоелемент у ділянці 315-540 нм; фотодіод - у ділянці 590-980 нм. Підключення фотоприймачів здійснюється перемикачем, який має шість положень. У перших трьох положеннях (1-3), позначених чорним кольором, працює фотоелемент, а трьох інших (1-3), позначених червоним кольором, – фотодіод. Струм фотоприймача підсилюється і подається на вимірювальний прилад (мікроамперметр), що фіксує струм, сила якого пропорційна інтенсивності світлового потоку, що проходить крізь досліджуваний розчин.
Визначення концентрації речовини у розчиніслід проводити в такій послідовності: вибір світлофільтра; вибір кювети; побудова калібрувального графіка для даної речовини; вимірювання оптичної густини досліджуваного розчину та визначення концентрації речовини в розчині.
Вибір світлофільтра. Наявність у колориметрі вузла світлофільтра і набору кювет дає змогу підібрати таку їх комбінацію, за якої похибка у визначенні концентрації буде найменшою. У кювету наливають розчин і визначають його оптичну густину при всіх наявних світлофільтрах. За одержаними даними будують криву залежності оптичної густини розчину від довжини хвилі, що відповідає максимуму коефіцієнта пропускання світлофільтрів, і відмічають ділянку кривої, де оптична густина має максимальне значення. Світлофільтр для роботи вибирають такий, щоб довжина хвилі, яка відповідає максимуму його коефіцієнта пропускання, припадала на відмічену ділянку спектральної кривої досліджуваного розчину.
Вибір кювети. Якщо розчин інтенсивно забарвлений, слід користуватися кюветами з малою робочою довжиною і навпаки. Заздалегідь підібрану кювету наливають розчин і вимірюють його оптичну густину. Значення оптичної густини розчину має становити 0,3-0,5, у разі одержання значень D<0,3 беруть кювету з більшою робочою довжиною, якщо D>0,5 – меншою. Максимальне значення D не має бути більше 1,2.
Для побудови калібрувального графіка готують серію розчинів досліджуваної речовини з відповідними концентраціями. Стандартні розчини готовлятьі за тих самих умов, що й розчини досліджуваної речовини. За допомогою фотоелектроколориметра вимірюють оптичну густину всіх розчинів і будують калібрувальний графік, відкладаючи на осі абсцис значення молярної концентрації розчину, а на осі ординат – значення оптичної густини. На графіку вказують назву речовини, товщину кювети, довжину хвилі.
Для визначення концентрації речовини готують її забарвлений розчин і вимірюють оптичну густину. У деяких випадках зазначають час, що минув від приготування забарвленого розчину до початку вимірювань. Потім за калібрувальним графіком знаходять концентрацію, що відповідає виміряному значенню оптичної густини. Під час проведення несерійних аналізів концентрацію досліджуваної речовини можна визначити шляхом порівняння оптичних густин стандартного й досліджуваного розчинів. Застосовують однаково приготовлені розчини порівняння. Вміст досліджуваної речовини обчислюють за формулою: Сд = Сст · Dд/Dст, де Dст і Dд – відповідно оптична густина стандартного розчину і проби, Сст і Сд – концентрація стандартного розчину і проби. Концентрацію речовини можна обчислити і за рівнянням калібрувального графіка, який пов’язує значення оптичної густини розчину D зі значення її концентрації С рівнянням прямої лінії: 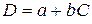 , де
, де 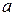 -оптична густина розчину за нульової концентрації досліджуваної речовини,
-оптична густина розчину за нульової концентрації досліджуваної речовини, 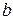 -кутовий коефіцієнт, який дорівнює tgα (α – кут нахилу прямої). Коефіцієнти
-кутовий коефіцієнт, який дорівнює tgα (α – кут нахилу прямої). Коефіцієнти 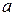 і
і 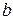 розраховують методом найменших квадратів за експериментальними даними вимірювання оптичної густини розчинів. Після розрахунків параметрів
розраховують методом найменших квадратів за експериментальними даними вимірювання оптичної густини розчинів. Після розрахунків параметрів 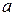 і
і 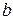 та їх інтервальних значень для визначення невідомої концентрації С виконують кілька вимірювань оптичної густини D, обчислюють середнє значення оптичної густини D і за рівнянням
та їх інтервальних значень для визначення невідомої концентрації С виконують кілька вимірювань оптичної густини D, обчислюють середнє значення оптичної густини D і за рівнянням 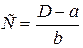 визначають концентрацію С.
визначають концентрацію С.
2. УФ-спектрофотометріянабула значного поширення і використовується для вивчення структури, якісного аналізу органічних речовин та їх кількісного визначення.
Спектроскопія у видимій та УФ-ділянках спектра – важливий і доступний метод аналізу. Його широко застосовують для аналізу багатьох органічних речовин, барвників, лікарських препаратів, контролю за перебігом технологічних процесів, у медичних та біологічних дослідженнях. Поглинання світла в УФ-ділянці спектра зумовлене змінами електронного стану молекул, тому спектри вбирання у видимій та УФ ділянці називаються електронними. Вони характерні для певних класів органічних речовин, оскільки поглинання УФ-випромінювання пов’язане з переходом валентних електронів одинарних і кратних зв’язків та електронів неподільних пар гетерероатомів, спостерігаються електронні переходи, для яких потрібна більша енергія, і тому вони знаходяться в межах вакуумного ультрафіолету. Атоми або групи атомів, які здатні поглинати світло, називаються хромофорами. Ароматичні амінокислоти (триптофан, тирозин і фенілаланін) – основні хромофори.
ІЧ-спектрофотометріювикористовують для ідентифікації, встановлення будови та кількісного визначення речовини, оскільки ІЧ-спектри мають багато смуг поглинання, які характеризують кожний тип зв’язку або функціональну групу. Метод ґрунтується на вивченні коливальних та обертальних спектрів поглинання в ІЧ-ділянці спектра. Виникнення спектра пов’язане з коливанням атомів у молекулі, тобто ІЧ-спектри зумовлені переходами між двома коливальними рівнями молекули. У спектрах цього типу виявлені коливання, що супроводжуються зміною дипольного моменту молекули.
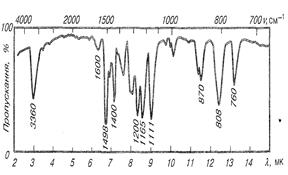 Коливання, за яких змінюється довжина хімічних зв’язків, називаються валентними (υ). Якщо під дією ІЧ-випромінювання змінюється кути між зв’язками, такі коливання називаються деформаційними і позначають δ. Кожна хімічна сполука має свій характерний спектр поглинання в ІЧ–ділянці спектра. Експериментально ІЧ–спектри речовини у різних агрегатних станах вивчають за допомогою ІЧ-спектрофотометрів.
Коливання, за яких змінюється довжина хімічних зв’язків, називаються валентними (υ). Якщо під дією ІЧ-випромінювання змінюється кути між зв’язками, такі коливання називаються деформаційними і позначають δ. Кожна хімічна сполука має свій характерний спектр поглинання в ІЧ–ділянці спектра. Експериментально ІЧ–спектри речовини у різних агрегатних станах вивчають за допомогою ІЧ-спектрофотометрів.
Рис.2 ІЧ-спектр поглинання 2-метил-4-хлорфенолу.
Спектрофотометричні методи аналізу, зокрема диференціальна спектрофотометрія і спектрофотометричне титрування, характеризуються високою точністю визначення (відн. похибка 0,1-0,5%), використовуються в дослідженнях, пов'язаних з проведенням агротехнічних заходів. Визначають активність ферментів дріжджів, зміст і склад фенольних, пектинових речовин, полісаха-ридів, інтенсивність забарвлення, вміст і склад ВМС, карбоніл-амінних реакцій.
3. Нефелометричний метод аналіза застосовують для аналізу колоїдних розчинів. Розсіювання світла (опалесценція) – найбільш типове оптичне явище в колоїдних розчинах. Опалесценцію, обумовлену світлорозсіюванням, спостерігали Фарадей (1857) і Тиндаль (1869). Релей вивів рівняння, що зв'язує інтенсивність розсіяного світла 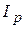 з інтенсивністю падаючого світла
з інтенсивністю падаючого світла 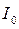 :
: 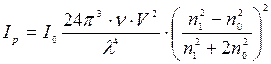 , де:
, де: 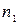 і
і 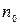 – показники переломлення частки й дисперсійного середовища;
– показники переломлення частки й дисперсійного середовища; 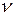 - часткова концентрація дисперсної фази;
- часткова концентрація дисперсної фази; 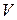 – об'єм однієї частки;
– об'єм однієї частки; 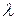 – довжина хвилі падаючого світла.
– довжина хвилі падаючого світла.
Рівняння справедливо за умови, якщо частки мають сферичну форму; не проводять електричний струм; не поглинають світло; колоїдний розчин розведений так, щоб відстань між частками більше довжини падаючого світла. Рівняння Релея виведене для незабарвлених золів (не поглинаючих світло). Багато колоїдних розчинів мають певне фарбування, тобто поглинають світло у відповідній частині спектра. Рівняння Релея: 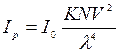 , де
, де 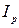 і
і 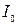 – інтенсивність розсіяного світлового потоку і світла, що падає,
– інтенсивність розсіяного світлового потоку і світла, що падає, 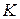 – стала величина для даного колоїда, N – кількість частин в одиниці об’єму, V – об’єм колоїдної частинки, λ – довжина хвилі світла, що падає. Нефелометричний метод аналіза визначає інтенсивність розсіяного світлового потоку (прилади нефелометри), а турбідиметричний – інтенсивність помутніння розчину і підпорядковується закону Бугера-Ламберта-Бера (прилади – фотоколориметри).
– стала величина для даного колоїда, N – кількість частин в одиниці об’єму, V – об’єм колоїдної частинки, λ – довжина хвилі світла, що падає. Нефелометричний метод аналіза визначає інтенсивність розсіяного світлового потоку (прилади нефелометри), а турбідиметричний – інтенсивність помутніння розчину і підпорядковується закону Бугера-Ламберта-Бера (прилади – фотоколориметри).
Особливість методу – правильне приготування колоїдних розчинів (вони агрегативно не стійкі, здатні коагулювати), підтримують умови їх приготування (температура, тиск, концентрація реагентів, техніка розчинення). Щоб розчини не коагулювали, вводять стабілізатори суспензій (желатин). Методом визначають йони, що здатні утворювати малорозчинні сполуки (сульфати, хлориди, хромати, дихромати, карбонати). Техніка аналізу.Переводять розчинну досліджувану речовину в малорозчинну. Працюють з такими концентраціями, щоб речовина не випала в осад, а знаходилась у вигляді суспензії. Стандарт і дослідний розчин для відпрацювання методики готують одночасно, в однакових умовах.
Недолік методу – приготування відносно стійкого розчину для аналізу.
Дата добавления: 2016-03-20; просмотров: 2791;
