Змістовий модуль 2. ЕЛЕКТРОХІМІЧНІ ТА ІНШІ МЕТОДИ АНАЛІЗУ
Лекція 5. Кондуктометричний метод аналізу
План лекції
1. Теоретичні основи метода, класифікація.
2. Пряма кондуктометрія та кондуктометричне титрування.
 1. Кондуктометричний метод аналізу заснований на залежності концентрації досліджуваних речовин від електропровідності електролітів. Цим методом можна визначати тільки електроліти (слабкі й сильні). Електропровідність є зростаючою функцією від концентрації. У дуже розведених (ідеальних) розчинах ця залежність лінійна: χ = k·С,де χ –електропровідність розчину (каппа), k – коефіцієнт пропорційності, що залежить від природи електроліту, С – концентрація електроліту. У концентрованих розчинах залежність більше складна й не підкоряється закону лінійності. Вимір електропровідності рідини проводять із використанням змінного струму звукової частоти в межах 20-0000 Гц. У прецизійнихі (точних) методах застосовують частоти порядку кілька тисяч Гц. У більш простих пристроях застосовують низькі частоти (промислова частота 50 Гц). Кондуктометричні методи, у яких застосовують більші частоти на рівні телевізійного віщання (МГц), називають високочастотні. Методи з використанням низьких частот називають низькочастотні. Для вимірів низькочастотними методами використовують мости змінного струму (міст Кольрауша).
1. Кондуктометричний метод аналізу заснований на залежності концентрації досліджуваних речовин від електропровідності електролітів. Цим методом можна визначати тільки електроліти (слабкі й сильні). Електропровідність є зростаючою функцією від концентрації. У дуже розведених (ідеальних) розчинах ця залежність лінійна: χ = k·С,де χ –електропровідність розчину (каппа), k – коефіцієнт пропорційності, що залежить від природи електроліту, С – концентрація електроліту. У концентрованих розчинах залежність більше складна й не підкоряється закону лінійності. Вимір електропровідності рідини проводять із використанням змінного струму звукової частоти в межах 20-0000 Гц. У прецизійнихі (точних) методах застосовують частоти порядку кілька тисяч Гц. У більш простих пристроях застосовують низькі частоти (промислова частота 50 Гц). Кондуктометричні методи, у яких застосовують більші частоти на рівні телевізійного віщання (МГц), називають високочастотні. Методи з використанням низьких частот називають низькочастотні. Для вимірів низькочастотними методами використовують мости змінного струму (міст Кольрауша).
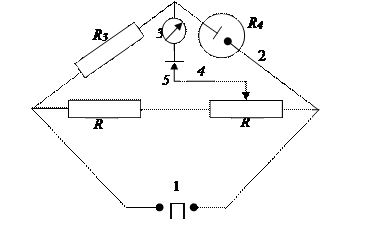
Рис.12. Схема моста змінного струму (Кольрауша), що працює на промисловій частоті:R4 – опір комірки; R3 – набір опорів, що дозволяють міняти діапазон вимірів; R1, R2 – опір з точно відомим значенням.
Міст дозволяє вимірювати опори розчинів електролітів порядку 0,3-30000 Ом. Робоча область показань мосту ділиться на п'ять меж вимірів. Чим нижче вимірюваний опір, тим менше опір порівняльного плеча мосту. Відношення плечей (R1/R2) може плавно регулюватися.
Міст грубо врівноважують обертанням рукояток плеча порівняння й реохорда, а потім ставлять нуль-інструмент (гальванометр постійного струму) у положення "точно" і обертанням рукоятки реохорда зрівнюють міст. Похибка вимірів опорів у межах 0,3-30 Ом не перевищує 5 %, а в межах 30-3000 Ом – не більше 1,5 %. Постійний струм для визначення електропровідності застосовувати небажано, на електродах у цьому випадку будуть проходити електродні процеси (електроліз), що викликають електрохімічну поляризацію електродів (виділення на електродах різних продуктів електролізу). Така поляризація спотворює результати вимірів. При використанні змінного струму величина цієї поляризації тим менше, чим вище його частота, тому в приладах високої точності використовують високі частоти.
2. Прямий метод заснований на безпосередньому визначенні електропровідності розчину. Для цього готують стандартні розчини з точно відомими концентраціями і вимірюють їхню електропровідність.
Будують графік залежності χ від концентрації електроліту С. Електропровідність сильно залежить від температури, тому при проведенні аналізу створюють умови, щоб температура залишалася постійної, для цього використовують термостати. При їхній відсутності знімають графічну залежність електропровідності (χ) від концентрації (С) при різних температурах (при кожній температурі одержують свої ізотерми). Вимірюють електропровідність досліджуваного розчину й за графіком знаходять його концентрацію. Як прилад, де використовується пряме визначення електропровідності, є солімер. З його допомогою визначають щільний залишок у паровому конденсаті. Його використовують при аналізі якості дистильованої води в медицині й в аналітичній хімії. Зміст щільного залишку в перерахуванні на Na2SO4 у якісній дистильованій воді не повиний перевищити 5 мг/л.
Кондуктометричне титруваннявикористовують, якщо досліджувані розчини пофарбовані й застосування звичайних індикаторів важко – фарбування розчину маскує фарбування індикатора. Метод заснований на одержанні кривої залежності електропровідності від кількості доданого титранта. Розглянемо три випадки кондуктометричного титрування.
Титрат – речовина, що досліджують. Титрант – речовина, якою титрують.
Титрування сильної кислоти лугом(рис. 13а).Титрат – HCl, титрант –NaOH. У точці А електропровідність максимальна, за рахунок повної дисоціації титрата (HCl). При додаванні титранту (по 0,5 мл) кількість іонів Гідрогену зменшується у результаті зв'язування гідроксид-іонами лугу з утворенням речовини, яка мало дисоціює.
HCl + NaOH = NaCl+ H2O.
Унаслідок зменшення концентрації самого рухливого іону Гідрогену (H+) електропровідність зменшується (відрізок АЕ). У точці еквівалентності(т. Е) усі іони Гідрогену зв'язані, тобто уся кислота відтитрована і електропровідність в цій точці мінімальна. Ця точка при даному виді титрування виражена чітко. При додаванні титранту на відрізку [ЕВ] збільшується електропровідність за рахунок збільшення концентрації іонів ОН– (другі за рухливістю іони після іону Гідрогену). Цей графік не симетричний. Відрізок [АЕ] більш гострий, а [ЕВ] більш пологий.

В В
А В А
Е Е2
Е Е1
А
|
Ve
а) б) в)
Рис. 13. Графік кондуктометричного титрування: а) хлоридної кислоти, б) оцтової кислоти, в) суміші хлоридної та оцтової кислот
Титрування слабкої кислоти лугом(рис. 13б).Титрат – CH3COOH, титрант –NaOH. У точці А електропровідність мінімальна, тому що ступінь дисоціації слабкої кислоти менше 3 %, отже, іонів Гідрогену мало. На ділянці [АЕ] при додаванні титранту по 0,5 мл відбувається реакція нейтралізації з утворенням солі слабкої кислоти (натрій ацетату), яка є більш сильним електролітом, ніж CH3COOH.
CH3COOH + NaOH = CH3COONa + H2O;
CH3COOН + Na+ + ОН– = CH3COO– + Na+ + H2O.
За рахунок появи цих іонів незначно збільшується електропровідність на відрізку [АЕ]. В точці Е оцтова кислота цілком відтитрована. В даному випадку точка еквівалентності виражена не чітко і находиться графічно по дотичним в точці перегину. На відрізку [ЕВ] концентрація збільшується за рахунок збільшення концентрації гідроксид–іонів.
Кондуктометричне титрування суміші сильної та слабкої кислот(рис. 13в). Титрат – HCl + CH3COOH, титрант – NaOH. В точці А максимум електропровідності за рахунок дисоціації сильної кислоти. На відрізку [АЕ1] при додаванні лугу титрується сильна кислота. В точці Е1 повністю відтитрована сильна кислота. На відрізку [Е1Е2] при додаванні NaOH титрується слабка кислота. На цій ділянці електропровідність незначно збільшується за рахунок утворення сильного електроліту – натрій ацетату. У точці Е2 оцтова кислота повністю відтитрована і ця точка відповідає загальному об'єму лугу, що знадобився на титрування обох кислот. Кількість кислот розраховуємо за формулами:
υпр (HCl) = Vе1·С(NaOH);
υпр (CH3COOH) = Vе2·С(NaOH), де Vе2 = Vе – Vе1
На ділянці [Е2В] електропровідність збільшується за рахунок накопичення гідроксид-іонів.
Дата добавления: 2016-03-20; просмотров: 953;
