Примеры реакций диссоциации слабых электролитов
Диссоциацию слабых электролитов описывают с использованием схемы ступенчатых равновесий. Ниже приведены реакции диссоциации в разбавленных растворах слабых кислот и оснований.
Пример 2.4. Электролитическая диссоциация слабых электролитов - кислот.
| |
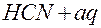 ⇄
⇄ 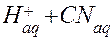 ;
;
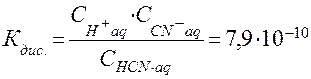 (при 250С),
(при 250С),
где 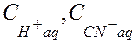 - молярные равновесные концентрации ионов Н+aq и CN-aq.
- молярные равновесные концентрации ионов Н+aq и CN-aq.
Пример 2.5. Электролитическая диссоциация слабых электролитов - оснований.
| |

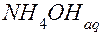 ⇄
⇄  ;
;
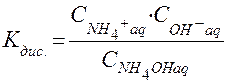 = 1,76×10-5 (при 250С),
= 1,76×10-5 (при 250С),
где 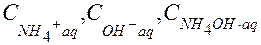 - равновесные молярные концентрации гидратированных ионов (NН4)+, (OH)- и молекул NH4OH соответственно.
- равновесные молярные концентрации гидратированных ионов (NН4)+, (OH)- и молекул NH4OH соответственно.
Чем меньше значение Кдис, тем слабее электролит.
Многоосновные кислоты и основания диссоциируют по стадиям.
Пример 2.6. Ступенчатая диссоциация слабых многоосновных кислот.
Н3ВО3 – слабая ортоборная кислота, диссоциирующая ступенчато в 3 стадии, каждая из которых имеет свою Кдис.
1 стадия:
H3ВО3 ⇄ H+ + H2BO3- ;
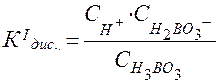 = 5,8∙10-10 (при t = 250С).
= 5,8∙10-10 (при t = 250С).
2 стадия:
H2BO3- ⇄ H+ + HBO32- ;
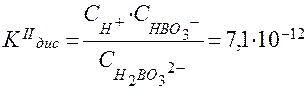 (при t = 250С).
(при t = 250С).
3 стадия:
HBO32- ⇄ H+ + BO33- ;
 1,6∙10-14 (при 250С).
1,6∙10-14 (при 250С).
Дата добавления: 2016-02-24; просмотров: 1990;
