Электролитическая диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, т.е. как сильные электролиты (первичная диссоциация).
Пример 2.9. Первичная диссоциация комплексных соединений.
комплексная кислота:
Н[PtCl4] + aq = H+ + [PtCl4]-;
комплексное основание:
[Ag(NH3)2]OH +aq = [Ag(NH3)2]+ + ОН-;
комплексная соль катионного типа:
[Cu(NH3)4]SO4 +aq = [Cu(NH3)4]2+ + SO42-;
комплексная соль анионного типа:
K4[Fe(CN)6] +aq = 4К+ + [Fe(CN)6]4-.
Комплексные частицы, или комплексы (молекулыили ионы), в свою очередь,диссоциируют лишь частично (aдис < 1%), т.е. являются слабыми электролитами (вторичная диссоциация).
Их диссоциация происходит ступенчато путем последовательного отщепления лигандов, причем каждая ступень характеризуется своей константой равновесия (константой диссоциации).
Пример 2.10. Вторичная диссоциация комплексных частиц:
[Cu(NH3)4]2+ ⇄ [Cu(NH3)3]2+ + NH3 ; (К1)
[Cu(NH3)3]2+ ⇄ [Cu(NH3)2]2+ + NH3 ; (К2)
[Cu(NH3)2]2+⇄ [Cu(NH3)]2+ + NH3 ; (К3)
[Cu(NH3)]2+ ⇄ Cu2+ + NH3 . (К4)
Прочность комплекса обычно характеризуют полной константой равновесия его диссоциации.Константа суммарной реакции диссоциации комплекса называется константой нестойкости КН. Она равна произведению констант диссоциации отдельных ступеней. Например, для суммарного уравнения для всех 4-х ступеней
[Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3
константа нестойкости равна:
 = 2,14∙10-13.
= 2,14∙10-13.
В общем виде для диссоциации комплекса [ MХn] Z:
[ MХ] Z ⇄  My+ + nXх
My+ + nXх
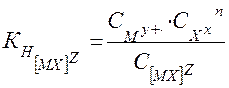 , (24)
, (24)
где z – заряд комплекса; n – заряд комплексообразователя; m – заряд лиганда.
Из приведенного уравнения легко определить концентрацию ионов комплексообразователя, образующихся при диссоциации комплекса, если принять, что активности ионов равны концентрациям, и в растворе нет избытка лигандов.
Чем меньше КН, тем прочнее комплекс.
Константа процесса, обратного диссоциации комплекса, т.е. процесса образования комплекса, называется константой устойчивости комплекса (Ку):
 (25)
(25)
Чем больше значение Ку, тем устойчивее комплексная частица.
Значения констант нестойкости некоторых комплексных ионов приведены в табл.12.
Таблица 12
Константы нестойкости комплексных ионов при 298 К
| Комплексный ион | КН | Комплексный ион | КН |
| [AgCl2]- | 1,76 ∙10-5 | [Hg(NH3)4]2+ | 5,3∙10-20 |
| [Ag(NH3)2]+ | 9,3∙10-8 | [Co(NH3)4]2+ | 2,8∙10-6 |
| [ Ag(CN)2]- | 8∙10-22 | [Fe(CN)6]4- | 1,1∙10-24 |
| [AgBr2] | 7,8∙ 10-8 | [Fe(CN)6]3- | 1∙10-31 |
| [Cu(NH3)4]2+ | 2,14∙10-13 | [Zn(NH3 )4] 2+ | 3,46∙10-10 |
| [Cu(CN)4]2- | 9,6 ∙10-29 | [Zn(OH)4]2- | 3,6∙10-16 |
| [Cd(NH3)4]2+ | 7,56∙10-8 | [Ni(NH3)4]2+ | 1,12∙10-8 |
| [Cd(CN)4]2- | 1,41∙10-19 | [Ni(CN)4]2- | 1,8∙10-14 |
| [HgCl4] 2- | 8,5∙10-16 | [PbBr4]2- | 1,1∙10-3 |
| [Hg(NH3)4]2+ | 5,4∙10-20 | [CuCl4]2- | 6,4∙10-6 |
| [HgBr4]2- | 1,1∙10-21 | [CdI4]2- | 8,1∙10-7 |
| [Hg(CN)4]2- | 4,0∙10-42 | [Co(NH3)6]2+ | 7,8∙10-6 |
| [HgI4]2- | 1,48∙10-30 | [Co(NH3)6]3+ | 7,1∙10-36 |
Задача 2.2.Рассчитайте концентрацию ионов Ag+ в 0,02 М растворе Na[Ag(CN)2] а) в отсутствии избытка лиганда; б) при наличии избытка ионов (СN)- при их концентрации в растворе NaCN 0,5 М.
Решение.
а) Уравнение первичной диссоциации комплексной соли как сильного электролита:
Na[Ag(CN)2] 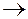 Na+ + [Ag(CN)2]- .
Na+ + [Ag(CN)2]- .
Уравнение суммарной диссоциации комплекса:
[Ag(CN)2]+ ⇄ Ag+ + 2 (CN )- , а КН = 8∙10-22 (см. табл.12).
Обозначим через x концентрацию Ag+. Тогда равновесная концентрация лиганда согласно уравнению равна 2 x, а равновесная концентрация недиссоциированного комплексного иона – (0,02 – х). Так как значение Кн очень мало, величиной х по сравнению с 0,02 можно пренебречь. С учетом этого запишем выражение для Кн:

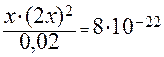 , откуда
, откуда  .
.
б) Концентрацию Ag+ рассчитываем аналогично, но концентрацию лиганда (CN)- принимаем равной 0,5 М:
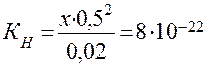 , откуда
, откуда  М.
М.
Таким образом, в 0,5 М растворе NaCN концентрация ионов Ag+ почти на 14 порядков ниже, чем концентрация ионов [H+] в воде. 
Дата добавления: 2016-02-24; просмотров: 2666;
