Протолитическая теория кислот и оснований
(Теория Бренстеда и Лоури)
По протолитической, или протонной теории кислота – это соединение, частица которого может отдать протон (Н+) другой частице – основанию. Согласно этой теории кислоты и основания - это вещества, теряющие и приобретающие протоны и называемые протолитами. Передача протона от кислоты к основанию называется протолизом. Кислота–донор протонов,а основание–акцептор Н+.
В результате отдачи протона сама кислота превращается в сопряженное ей основание. Основание – акцептор Н+ - превращается в сопряженную ему кислоту.
В следующей реакции протолитического равновесия:
НА + В ⇄А- + НВ+ (14)
НА – кислота, А- - сопряженное ей основание; В – основание, НВ+ - сопряженная ему кислота.
Таким образом, в равновесной протолитической реакции присутствуют две сопряженные пары «кислота / основание»: НА /А- и НВ+ / В.
Кислоты и основания, или протолиты, могут быть нейтральными (молекулы), катионными или анионными:
Анионные Молекулярные Катионные
протолиты протолиты протолиты
кислоты:
HSO3 -; HS- СН3СООН, НСl NH4+; (Zn∙H2O)2+
основания:
СО32-; SO32- NH3 (CuOH)+
Протонодонорная способность вещества - это его кислотность; протоноакцепторная способность - это основность. Эти свойства определяются сродством к протону, т.е. величиной энтальпии реакции присоединения протона.
При кислотно-основном взаимодействии роль основания играет тот партнер, у которого протонное сродство выше.
Из термохимических уравнений:
NH3(г) + H+(г)  NH4+(г); ΔH° = -868 кДж;
NH4+(г); ΔH° = -868 кДж;
H2O(г) + H+(г) 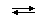 H3O+(г); ΔH° = -689 кДж;
H3O+(г); ΔH° = -689 кДж;
OH-(г) + H+(г) 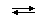 H2O(г) ; ΔH° = -1644 кДж;
H2O(г) ; ΔH° = -1644 кДж;
F-(г) + H+(г) 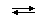 HF(г) ; ΔH° = -547 кДж;
HF(г) ; ΔH° = -547 кДж;
следует что:
1) NH3 - более сильный акцептор протона и более сильное основание, чем H2O, а NH4+, наоборот, более слабый донор протона и более слабая кислота, чем H3O+;
2) OH- - более сильное основание, чем F-, а H2O - более слабая кислота, чем HF.
В ряду жидких веществ: NH3, H2O, C2H5OH, HCN, H2S, CH3COOH, HNO3, H2SO4, HF, HClO4 сродство к протону убывает от NH3 к HClO4.
Количественной характеристикой состояния протолитического равновесия обратимой реакции между кислотой HA и основанием (растворителем) HL
HA(s) + HL 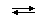 A-(s) + H2L+(s)
A-(s) + H2L+(s)
является величина Kк - константа кислотности:
Kк = [A-] . [H2L+] / [HA] = Const = f (T). (15)
Чем больше значение Kк, тем более сильной кислотой является протолит HA в данном растворителе HL.
Количественной характеристикой состояния протолитического равновесия в реакции между основанием B и кислотой (растворителем) HL
В + HL  НВ+ + L-
НВ+ + L-
является величина Kо - константа оснόвности:
Kо = [HB+] . [L-] / [B] = Const = f(T). (16)
Чем больше значение Kо, тем более сильным основанием является протолит B в данном растворителе HL.
Пример 2.1.
а) HCl(г) + H2O⇄ H3O+ + Cl-,
где HCl - кислота, а Н2О – основание.
б) СН3СООН + Н2О ⇄ СН3СОО- + Н3О+,
где СН3СООН – кислота, Н2О - основание.
в) NH3(г) + Н2О ⇄ NH4+ + ОН-,
где NH3 - основание, а Н2О - кислота.
г) HSO3- + Н2О ⇄ H2SO3 + OH-,
где HSO3- - основание, а Н2О - кислота.
д) HSO3- + ОН- ⇄SO32- + Н2О ,
где HSO3- - кислота, ОН- - основание.
Существуют протоносодержащие частицы HA- (молекула или ион) способные проявлять себя и основанием, и кислотой (т.е. способные как отдавать, так и принимать протоны). Такие протолиты получили название амфолитов.
Н2О, HSO3- - амфолиты, или протолиты, кислотно-основное поведение которых зависит от других участников реакции.
Амфолиты, или амфипротонные частицы при столкновении могут вступать в реакции автопротолиза:
Пример 2.2.
а) H2BO3- + H2BO3- ⇄ H3BO3 + HBO32-;
кислота основание кислота основание
Сопряженные пары : H2BO3- / HBO32- и H3BO3 / H2BO3-
б) Н2О + Н2О ⇄ Н3О+ + ОН-
кислота основание кислота основание
Сопряженные пары: Н2О / ОН- и Н3О+/ Н2О.
в) (ZnOH)+∙H2O + (ZnOH)+ ∙H2O ⇄ Zn(OH)2 + Zn+2 ∙H2O+ H2O
Гидратированные катионы металлов, образующих слабые гидроксиды-основания, проявляют свойства протолитов-кислот, «выбрасывая» из молекулы Н2О гидратной оболочки Н+.
г) Cu2+∙ H2O ⇄ (CuOH)+ + H+
Катионы щелочных и щелочноземельных металлов (Na+,K+, Ca2+,Ba2+ и др.) протолитами не являются.
Анионы сильных кислот (Сl -, Br -, I -, NO3 -, ClO4 - и т.п.) также не являются протолитами.
Дата добавления: 2016-02-24; просмотров: 7685;
