Теория электролитической диссоциации
Согласно теории электролитической диссоциации Оствальда-Аррениуса (1887 г.) вещества - электролиты в водных растворах частично или полностью распадаются на ионы.
Распад молекул растворенного вещества на ионы называется электролитической диссоциацией или ионизацией. Вода относится к наиболее сильно ионизирующим растворителям. Процесс диссоциации электролита в воде обусловлен эффектом ионизации под действием растворителя молекул с ионной или ковалентной полярной связью. Его можно изобразить схемой:
KtnAnm + aq ⇄nKtm+aq + mAnn-aq ,
где KtnAnm - молекула растворенного вещества-электролита; аq - молекулы воды; Ktm+aq - гидратированные, т.е. окруженные молекулами воды, ионы - катионы; Ann- aq - гидратированные ионы – анионы; m и n – число катионов и анионов.
Катионы Ktm+ связаны с молекулами воды гидратной оболочки донорно-акцепторной связью и являются акцепторами электронных пар, а донорами являются атомы кислорода в молекулах Н2О.
Анионы Ann- связаны с молекулами Н2О либо кулоновскими силами, либо водородной связью, при образовании которой они являются донорами электронных пар.
Обычно пользуются упрощенными уравнениями электролитической диссоциации, в которых гидратная оболочка ионов не указывается.
KtnAnm + aq ⇄nKtm+ + mAnn- . (12)
К электролитам относятся кислоты, соли, основания. Согласно теории электролитической диссоциации :
Кислоты – это соединения, диссоциирующие в водных растворах с образованием катионов одного вида - ионов Н+, например,
НСl ® Н+ + Cl- .
Основания – это соединения, образующие в водных растворах анионы одного вида – гидроксид-ионы ОН- , например:
Ca(OH)2 ® Ca2+ + 2(OH)-.
Средние соли – это соединения, образующиепри электролитической диссоциациикатионы металлов, комплексные катионы (в том числе катион аммония NH4+) и одно- или многоатомные анионы – кислотные остатки, например:
K2S ® 2K+ + S2- ;
NH4 NO3 ® NH4 + + NO3 -.
Все вещества-электролиты принято подразделять на сильные и слабые по степени их диссоциации в водном растворе.
Степенью диссоциации 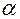 называют отношение
называют отношение
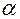 = Си /Со, (13)
= Си /Со, (13)
где Си - концентрация ионизированных молекул;
Со - общая концентрация растворенного вещества.
Степень диссоциации 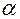 выражают в долях единицы или в процентах. Если
выражают в долях единицы или в процентах. Если 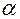 = 0, то диссоциация отсутствует. Если
= 0, то диссоциация отсутствует. Если 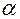 = 1 (или 100%), то электролит полностью распадается на ионы.
= 1 (или 100%), то электролит полностью распадается на ионы.
В общем случае 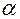 сложным образом зависит от природы электролита, природы растворителя, температуры и концентрации раствора. Экспериментальные данные показывают, что значение
сложным образом зависит от природы электролита, природы растворителя, температуры и концентрации раствора. Экспериментальные данные показывают, что значение 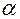 может колебаться в пределах от 0 до 1.
может колебаться в пределах от 0 до 1.
Дата добавления: 2016-02-24; просмотров: 1054;
