Способы выражения состава раствора
Основные свойства растворов
Раствором называют многокомпонентную гомогенную систему переменного состава, каждый из компонентов которого равномерно распределен в массе другого в виде молекул, атомов или ионов.
Наиболее изученными, широко распространенными и используемыми являются жидкие растворы. В зависимости от природы растворителя различают водные растворы (растворитель – вода) и неводные (все другие растворители). В настоящем пособии рассматриваются только водные растворы.
Условно компоненты раствора делятся на растворенное вещество и растворитель. Если раствор образуется при смешивании компонентов одинакового агрегатного состояния, растворителем считается тот компонент, содержание которого в растворе больше. В остальных случаях растворителем является компонент, агрегатное состояние которого не меняется при образовании раствора.
Образование раствора представляет собой сложный процесс, часто сопровождающийся изменением объема и тепловыми эффектами.
Растворение в жидкостях газов и жидкостей обычно сопровождается выделением теплоты (∆ Нраств < 0).
Изменение теплоты при образовании раствора можно представить как сумму эндо- и экзотермических процессов, сопровождающих растворение. Процесс растворения любого вещества в жидкости протекает в 3 стадии:
1) разрушение химических и межмолекулярных связей растворяемого вещества, которое требует затраты энергии (∆Нразр> 0);
2) сольватация - химическое взаимодействие растворителя с растворенными частицами вещества с образованием сольватов (в водных растворах – гидратов) - процесс экзотермический (∆ Нгидр < 0);
3)диффузия - равномерное распределение сольватов (гидратов) в объеме раствора - происходит с энергетическими затратами (∆Ндиф > 0).
Общий тепловой эффект растворения твердого вещества:
∆Нраств = ∆Нразр+ ∆Нгидр + ∆Ндиф. (1)
От соотношения составляющих энергетических эффектов зависит знак суммарного теплового эффекта процесса растворения. В большинстве случаев растворение вещества – процесс эндотермический.
Свойства растворов зависят от природы образующих их компонентов, состава раствора, температуры, давления.
По содержанию растворенного вещества растворы качественно характеризуют как предельно разбавленные (содержащие «следы» растворенного вещества), разбавленные (содержание растворенного вещества невелико), концентрированные (содержание растворенного вещества значительно).
Способы выражения состава раствора
Количественный состав раствора выражается понятием «концентрация», под которым понимается содержание растворенного вещества (в определенных единицах) в единице массы или объема раствора (иногда – растворителя). Существуют различные способы выражения концентрации растворов. Ниже приведены наиболее применяемые в химической практике концентрации, единицы их измерения, формулы для их расчета и перехода из одной концентрации в другие.
Основные обозначения, используемые при расчете концентраций растворов, приведены в табл.1.
Таблица 1
Основные обозначения, используемые при расчете концентраций
| Характеристики | Растворенное вещество | Растворитель | Раствор |
| m – масса, г | m1 | m2 | m = m1 + m2 |
| V - объем, см3 | V1 | V2 | V = V1 + V2 
|
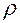 - плотность,
г /см3 - плотность,
г /см3
| - |
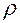 Н2О = 1,0 Н2О = 1,0
|
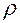 = m/V = m/V
|
| М – мольная масса, г/моль | М1 | - | - |
| Э – масса эквивалента, г/моль-экв | Э1 = М1/Z, где Z - суммарный заряд катиона | - | - |
| n – количество вещества, моль | n1 | n2 | n = n1 + n2 |
Примечание. Концентрации компонентов , соответствующие состоянию равновесия реакции, или равновесные концентрации, часто обозначают квадратными скобками, например: [Н+], [ОН-], [Н2О].
К основным способам выражения концентрации растворов, применяемым в химической практике, относятся следующие.
Массовая доля или процентное содержание – С% – соотношение масс растворенного вещества m1 и раствора m, выраженное в долях единицы или процентах.
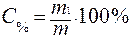 ;
; 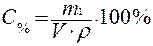 , (2)
, (2)
где V – объем раствора см3; r - плотность раствора г /см3.
Концентрация, выраженная в граммах на литр, Сг/л показывает, какая масса растворенного вещества содержится в 1000 мл раствора.
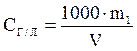 . (3)
. (3)
Масса (г) растворенного вещества в 100 г воды (растворителя), С* (г/100 г Н2О). Удобна при приготовлении растворов.
С*(г /100 г Н2О)= 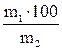 . (4)
. (4)
Молярная концентрация, или молярность СМ– число молей растворенного вещества n1, содержащееся в 1000 мл раствора. Является стандартной концентрацией. Используется в выражениях большинства химических законов (кроме закона эквивалентов).
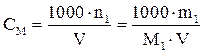 . (5)
. (5)
Единицы измерения – моль/л, или М. Раствор, содержащий 1 моль растворенного вещества в 1 литре раствора, называют одномолярным раствором и обозначают 1 моль/л или 1 М.
Моляльная концентрация или моляльность, Сm –число молей растворенного вещества, содержащееся в 1000 г растворителя (моль/1000 г растворителя). Используется преимущественно в физической химии.
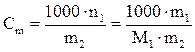 . (6)
. (6)
Молярная доля хi или молярное содержание хi ×100 % – число молей компонента ni (растворителя или растворенного вещества), отнесенное к сумме молей всех компонентов раствора S ni,
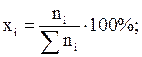 S хi = 1. (7)
S хi = 1. (7)
Титр, Т– количество граммов растворенного вещества, содержащееся в 1 см3 (мл) раствора. Обычно используется в аналитической химии.
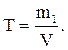 (8)
(8)
Нормальная концентрация, или нормальность,Сн –число грамм-эквивалентов растворенного вещества в 1000 мл раствора. Используется в выражении закона эквивалентов. Принято называть раствор, содержащий 1 моль эквивалентов вещества в 1 литре раствора, «однонормальным» и обозначать 1н или 1N.
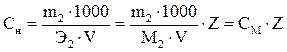 , (9)
, (9)
где Z – суммарный заряд катиона.
Способы выражения концентраций приведены в табл.2.
Таблица 2
Способы выражения концентраций
| Концентрация | Формула | Определение |
| СМ – молярная концентрация (молярность); моль/л, или М | 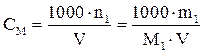
| Количество молей растворенного вещества в 1 л раствора |
| С% - массовая доля; в % или долях единицы | 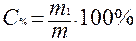
| Масса (г) растворенного вещества в 100 г раствора |
| СГ/Л – концентрация, выраженная в г/л | 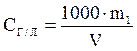
| Масса (г) растворенного вещества в 1 л (1000 см3) раствора |
| С* (г /100 г Н2О) – масса растворенного вещества в 100 г воды (растворителя) |
С*(г/100гН2О)= 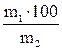
| Масса (г) растворенного вещества в 100 г растворителя (воды) |
| Сm – моляльная концентрация ( моляльность), моль/1000 г растворителя; | 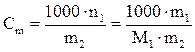
| Число молей растворенного вещества на 1000 г растворителя |
| Т – титр; г/см3 (г/мл) | 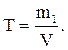
| Масса (г) растворенного вещества в 1 см3 (мл) раствора |
| СН или СN - нормальная концентрация; моль-экв/л | 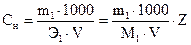
| Число моль-экв. растворенного вещества в 1 л раствора |
В лабораторной практике для приготовления разбавленных растворов из более концентрированных  часто пользуются правилом смешения, или «правилом креста».
часто пользуются правилом смешения, или «правилом креста».
Пример 1.1.
Приготовить 25%-ный раствор серной кислоты из 70%-ного и 10%-ного растворов. Для этого необходимо рассчитать, в каком массовом соотношении нужно смешать эти растворы.
Решение:В 100 гпервого раствора содержится избыток растворенного вещества по сравнению с требуемым в (70 – 25) г = 45 г.
В 100 г второго вещества недостает (25 -10) г = 15 г по сравнению с требуемым.
Пусть для приготовления раствора заданной концентрации требуется х, г 70 % -ного и у,г 10%-ного растворов. Избыток вещества – серной кислоты – в хг первого раствораравен: 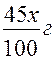 , а недостаток в у г второго -
, а недостаток в у г второго - 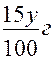 . Для получения раствора заданной концентрации избыток растворенного вещества от первого раствора должен полностью компенсировать его недостаток от второго раствора. Следовательно:
. Для получения раствора заданной концентрации избыток растворенного вещества от первого раствора должен полностью компенсировать его недостаток от второго раствора. Следовательно:
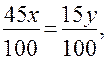 или
или 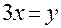 .
.
Решение этой задачи можно изобразить схемой – «крестом»:

 70% ------------
70% ------------  15 масс. частей
15 масс. частей

 25%
25%
 10%-------------
10%-------------  45 масс. частей,
45 масс. частей,
где концентрации исходных растворов – 70% и 10% записываем в первом столбце, заданную концентрацию - 25% - во втором столбце посередине, а разности между исходными концентрациями и заданной записываем в третьем столбце в направлении пересекающихся диагоналей
(см. стрелки на схеме).
Ответ: на 15 массовых частей 70%-ного раствора надо взять 45 массовых частей 10%-ного раствора, т.е. смешать их в отношении 1:3 (по массе).
Дата добавления: 2016-02-24; просмотров: 5882;
