Современные представления о природе кислот
И оснований
Представления теории электролитической диссоциации Аррениуса оказались не всегда применимы для объяснения кислых и основных свойств веществ. Например, аммиак NH3 имеет основные свойства, но не может диссоциировать с образованием в растворе ионов ОН-.
Кроме того, доказано, что существование Н+-иона в чистом виде («голого протона») невозможно. Более вероятно существование Н+ в составе гидратных частиц, содержащих как минимум 4 молекулы Н2О, например, Н9О4+.
В теории Аррениуса вода рассматривается лишь как среда, химически не участвующая в реакциях диссоциации кислот и оснований. Однако, позднее было доказано, что при растворении веществ-электролитов в воде протекает не простой распад на ионы, а физико-химическое взаимодействие между частицами вещества и водой. Участие воды в реакциях такого рода подтверждено экспериментально, однако отобразить это взаимодействие с позиций теории Аррениуса нельзя.
В рамки определений Аррениуса не укладывались реакции гидролиза солей, образованных слабыми кислотами или слабыми основаниями. Несмотря на то, что подобные соли создают в растворе кислую или щелочную среду, кислотами или основаниями по Аррениусу они не являются.
По Аррениусу кислые соли должны диссоциировать в воде так же ступенчато, как многоосновные кислоты, например:
NaHCO3 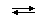 Na+ + HCO3-,
Na+ + HCO3-,
HCO3- 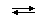 H+ + CO32-,
H+ + CO32-,
создавая в растворе кислую среду, обусловленную избытком ионов H+.
Однако экспериментальные данные показывают, что в растворах таких солей среда может быть как кислой (например, в растворе NaHSO4), так и щелочной (например, в растворе NaHCO3), хотя избыточное содержание ионов OH- в таких растворах теория Аррениуса объяснить не может.
Эти и другие факты привели к необходимости пересмотра понятий «кислота» и «основание» и созданию других теорий кислот и оснований.
Рассмотрим две наиболее распространенные из них.
Дата добавления: 2016-02-24; просмотров: 1032;
