Активная и общая кислотность растворов. Кислотность и щелочность почв.
Любая кислота или щелочь содержит в свободном состоянии определенное количество ионов Н+ (точнее, Н3О+)или ОН-. При нейтрализации кислоты щелочью ионы связываются в молекулу воды.
|

При этом все катионы водорода, содержащиеся в растворе, участвуют в процессе нейтрализации.
Таким образом, общее количество катионов водорода, содержащееся в единице объема раствора, носит название общей или титруемой кислотности. Количество же свободных гидратированных ионов водорода составляет так называемую активную кислотность раствора.
И та и другая кислотность выражаются обычно в моль/л или, что то же самое, в кг/м3. В табл. 4.8 сопоставлены титруемая (общая) и активная кислотность для 1 н. растворов некоторых кислот.
Из данных этой таблицы видно, что различные кислоты при одинаковой общей кислотности довольно резко отличаются по активной кислотности.
Концентрация ионов Н+ (в моль/л), а также рН для одноосновных слабых кислот и оснований могут быть вычислены теоретическим путем. Покажем это на конкретном примере с уксусной кислотой, которая диссоциирует по уравнению
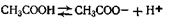
Применяя к этой реакции закон действующих масс, получим
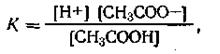
| 4.55 |
где К — константа электролитической диссоциации уксусной кислоты. Из уравнения диссоциации уксусной кислоты имеем [Н+] = [СН3СОО-]. Стало быть, уравнение (4.55) можно написать так:
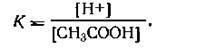
| 4.56 |
Если обозначить через а степень диссоциации уксусной кислоты, а через С аналитическую концентрацию ее, получим
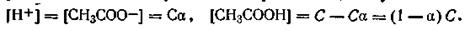
Уравнение (4.56) можно представить в следующем виде:
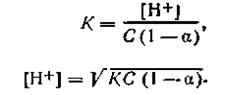
| 4.57 |
Учитывая, что для слабых кислот a<<l, можно без большой погрешности принять (1—а)≈1, тогда
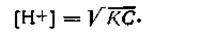
| 4.58 |
Прологарифмировав это выражение и поменяв знаки на обратные, получим окончательную формулу для вычисления рН слабых одноосновных кислот:
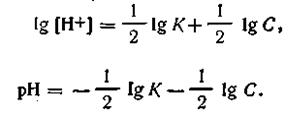
| 4.59 |
Обозначая —lgК через рК, получим
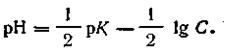
| 4.60 |
Совершенно аналогичная формула получается и в случае одноосновного слабого основания, например
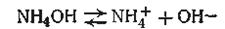
В данном случае согласно уравнению (4.60) получим
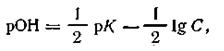
| 4.61 |
где К — константа диссоциации слабого основания, С — концентрация этого основания. С учетом уравнения (4.54) окончательная формула для вычисления рН одноосновных слабых оснований будет иметь вид
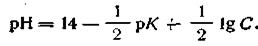
| 4.62 |
Пример. Вычислить рН 0,1 н. раствора уксусной кислоты. Поскольку константа диссоциации уксусной кислоты К= 1,85·10-5, для решения воспользуемся формулой (4.62):
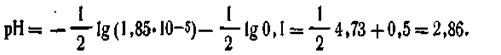
| 4.63 |
Дата добавления: 2016-02-20; просмотров: 5618;
