Биологическое значение буферных систем. Буферность почв и почвенного раствора.
В живых организмах буферные системы поддерживают постоянство рН в крови и тканях. В процессе обмена в живом организме образуются большие количества кислых продуктов. Так, в организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 20—30 л однонормальной сильной кислоты. Сохранение постоянства реакции внутри организма обеспечивается наличием в нем мощных буферных систем. В организме человека особенно большую роль играют белковый, бикарбонатный и фосфатный буферы.
Буферной смесью крови является карбонатная смесь, состоящая из NaНСО3 и СО2, а также фосфатные смеси, состоящие из NaН2РО4 и Na2HPО4. Бикарбонатный буфер присутствует в крови также в довольно большой концентрации. Зная количества бикарбонатов и свободно растворенного СО2, можно определить рН крови по следующей формуле:
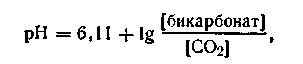
| 4.82 |
где 6,11—показатель константы, характерной для крови и близкой по величине к кажущейся константе диссоциации угольной кислоты; [бикарбонат] — концентрация бикарбоната в объемных долях, в процентах; [СО2] — концентрация свободно растворенной угольной кислоты. Этой формулой широко пользуются на практике при различных медико-биологических исследованиях.
Однако наиболее мощными буферными системами крови являются так называемые гемоглобиновые буферы, которые составляют примерно 75% всей буферной емкости крови. Сущность действия этих буферных систем заключается в следующем: Кислые продукты обмена веществ взаимодействуют с калиевой солью гемоглобина с образованием эквивалентного количества их калиевых солей и свободного гемоглобина, обладающего свойствами слабой органической кислоты. Таким образом, подкисления крови не происходит.
Углекислота, связанная с гемоглобином, в конечном итоге выделяется в воздух через легкие, однако сдвига рН крови в щелочную сторону не происходит, так как образующийся при этом оксигемоглобин значительно кислее гемоглобина.
Большое значение в поддержании постоянного рН внутри живых клеток имеет так называемый белковый буфер. Этот буфер состоит из протеина (Pt) и его соли, образованной сильным основанием Na или К. Компоненты этого буфера можно представить так: Pt—СООН — слабо диссоциирующая кислота, Pt—COONa — ее соль:
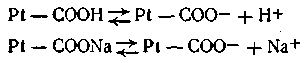
Эта буферная система действует аналогично буферным смесям, рассмотренным ранее. При увеличении концентрации ионов водорода соль белка реагирует с кислотами, образуя весьма слабо диссоциирующую кислоту и нейтральную соль:
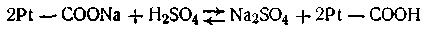
При взаимодействии же с щелочами в реакцию вступает кислота и вместо сильного основания образуется слабоосновная соль белка:
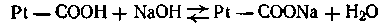
Благодаря амфотерности даже отдельная белковая молекула обладает буферным действием, т. е. способностью связывать кислоты и щелочи с образованием солей:
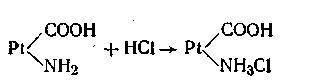
Как видим, при добавлении сильной кислоты образуется слабокислая соль белка (так называемый солянокислый протеин). Прибавление щелочи приводит к. образованию слабоосновной соли белка (протеината натрия):
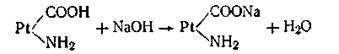
Отметим, что растительные соки также представляют собой буферные растворы сложного состава.
Почвы и почвенные растворы аналогично растворам биологического происхождения обладают определенной буферностью, что хорошо видно из следующего опыта. Если взять две навески почв с нейтральной реакцией (одну суглинистую, другую — песчаную) и к обеим навескам добавить одинаковое количество кислоты 0,05 н. концентрации, то после взбалтывания рН равновесных растворов суспензий окажется неодинаковой. рН суспензии песчаной почвы будет значительно ниже, чем суглинистой. Таким образом, суглинистая почва препятствует сильному подкислению, обладает гораздо большей буферностью по сравнению с песчаной.
Буферность твердой фазы почвы обусловливается в основном двумя факторами: количеством почвенных коллоидов и составом поглощенных катионов: Большое значение имеют также энергия поглощения водородных ионов почвенными коллоидами и степень диссоциации последних. Поскольку органические вещества почвы преимущественно состоят из слабых кислот (т. е. кислот с очень малой константой диссоциации), они в значительной степени связывают поступающие в почвенный раствор ионы водорода и тем самым оказывают буферное действие против подкисления почвы. Опыт показывает: чем больше данная почва содержит органического вещества, тем выше ее буферное действие.
Почвенный раствор обладает буферностью в том случае, если в нем присутствуют соли сильных оснований и слабой кислоты. К сильным основаниям относятся натрий, калий, к более слабым — кальций и магний. Из слабых кислот в почвах присутствуют гуминовые и фульвокислоты, щавелевая и др. Из сильных кислот в почве могут присутствовать серная и азотная. Эти кислоты попадают в почву с удобрениями или оcвобождаются при поглощении растениями питательных элементов из физиологически кислых удобрений, например аммония из сульфата аммония и т. д. Чем выше содержание в почвенном растворе этих солей, тем выше его буферная способность.
Практика сельского хозяйства показывает, что в слабобуферных почвах реакция среды может довольно резко изменяться от внесения физиологически кислых или щелочных удобрений. В почвах, обладающих хорошей буферностью, этого не происходит.
Буферность почв по отношению, например, к кислотам определяют титрованием, добавляя к почвенной суспензии небольшими порциями кислоту и измеряя реакцию суспензии (рН). Если при этом реакция изменяется очень заметно, почва обладает сравнительно малой буферностью. Внесением органических и минеральных коллоидов (например, ила или глин) буферность почвы можно значительно улучшить. В кислых почвах буферность по отношению к кислотам можно повысить внесением в почву известняка (СаСОз). Вносить минеральные удобрения в почвы с малой буферностью рекомендуется в несколько приемов и уменьшенными дозами, чтобы предотвратить резкое смещение реакции среды.
Дата добавления: 2016-02-20; просмотров: 4194;
