Буферные растворы и буферное действие.
Как показывает опыт, разбавленные растворы сильных кислот и оснований, обладающие слабокислой или слабощелочной реакцией, характеризуются непостоянством рН. Однако смесь, например, уксусной кислоты и ее соли CH3COONa обладает способностью сохранять постоянство рН. Можно к этой смеси добавить небольшое количество кислоты или щелочи, а также разбавить ее, но рН раствора при этом почти не изменится. Свойство растворов сохранять определенное значение рН называется буферным действием. Растворы, обладающие буферным действием, получили название буферных растворов или буферных смесей.
Буферные растворы по своему составу бывают в основном двух типов. Они могут состоять из слабой кислоты и ее гидролитически щелочной соли и слабого основания и гидролитически кислой соли этого основания.
В качестве иллюстрации можно привести следующие буферные смеси:
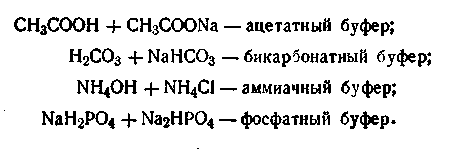
Последний буфер, как видим, состоит из смеси двух солей, одна из которых — однозамещенная, вторая — двухзамещенная соль фосфорной кислоты. Причем первая соль (NaH2PO4) играет роль слабой кислоты. Буферным действием могут обладать растворы, состоящие из анионов разных слабых кислот, такие, как фосфатцитратный буфер Na2НРО4 + СбН8О7.
Сущность буферного действия смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного буферного раствора. В этом растворе происходят следующие реакции электролитической диссоциации:
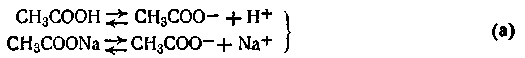
Поскольку степень диссоциации кислоты очень мала, в растворе преобладают ее недиссоциированные молекулы. Ацетат натрия, являясь сильным электролитом, диссоциирует полностью на ионы СН3СОО- и ионы Na+. Таким образом, в ацетатной буферной смеси присутствие в большом количестве анионов СН3СОО- смещает равновесие при диссоциации уксусной кислоты в сторону образования ее молекул. Причем диссоциация уксусной кислоты может быть настолько подавленной, что кислоту можно считать практически недиссоциированной. В результате этого активная кислотность смеси очень мала. Добавление кислоты или щелочи к ацетатной смеси не вызывает существенного изменения концентрации водородных ионов в растворе. Так, при добавлении соляной кислоты к ацетатному буферу происходит реакция обменного разложения с одним из компонентов смеси (CH3COONa):
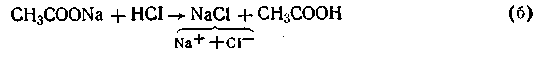
Как видим, сильная кислота в результате этой реакции заменяется эквивалентным количеством слабой кислоты. В соответствии с законом разбавления Оствальда увеличение концентрации уксусной кислоты понижает степень ее диссоциации, в результате чего концентрация ионов водорода в буферном растворе увеличивается очень незначительно.
Так же незначительно изменяется рН буферного раствора при добавлении к нему небольшого количества щелочи. При этом щелочь реагирует с уксусной кислотой (реакция нейтрализации), в результате чего гидроксид-ионы связываются с ионами водорода с образованием молекул воды:
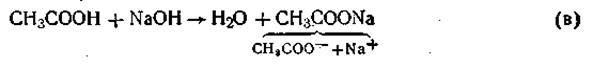
В конечном итоге этой реакции добавляемая
щелочь заменяется эквивалентным количеством слабоосновной соли, которая влияет на реакцию среды в значительной меньшей степени, чем NaOH. Поскольку в результате этой реакции уксусная кислота расходуется, можно было бы ожидать значительного снижения содержания ионов Н+. Однако вместо прореагировавших ионов кислоты Н+ и СН3СОО- за счет потенциальной кислотности образуются новые ионы Н+ и СН3СОО-, и активная кислотность смеси (рН) почти не изменяется.
Как показывает опыт, каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система стремится сохранить при добавлении к ней кислоты или щелочи. Рассмотрим на примере ацетатной буферной смеси, что же определяет ее рН.
В соответствии с законом действующих масс константа диссоциации уксусной кислоты

| 4.75 |
Это равенство справедливо для раствора, в котором содержится только одна уксусная кислота. Как уже отмечалось, добавление к раствору уксусной кислоты ацетата натрия подавляет ее диссоциацию, в результате чего концентрацию молекул недиссоциированной СН3СООН можно без больших погрешностей принять равной общей концентрации кислоты, т. е.
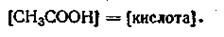
| 4.76 |
Учитывая, что соль CH3COONa как сильный электролит в водном растворе диссоциирована полностью, можно принять, что общая концентрация аниона СН3СОО- практически равна аналитической концентрации соли в данной буферной смеси, т. е.
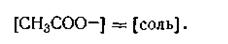
| 4.77 |
Подставляя значения (4.76) и (4.77) в уравнение константы диссоциации (4.75), получим
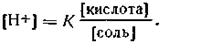
| 4.78 |
Логарифмируя это выражение и меняя знаки, запишем:
—lg[H+] = - lg K + lg[соль]—lg [кислота] или
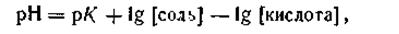
| 4.79 |
где рК— отрицательный логарифм константы диссоциации уксусной кислоты.
Отметим, что уравнение (4.79) справедливо и для буферных растворов, состоящих из смеси слабого основания и гидролитически кислой соли. В этом случае уравнение будет иметь вид
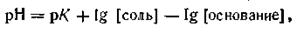
| 4.80 |
где рК — отрицательный логарифм константы диссоциации слабого основания. Из приведенных уравнений следует, что рН буферного раствора зависит от величины константы диссоциации слабой кислоты или слабого основания, а также от соотношения концентраций компонентов буферных смесей.
Для приготовления буферных смесей с желаемым значением рН необходимо взять слабые кислоты или основания с соответствующими значениями констант диссоциации, а также подбирать определенные соотношения компонентов.
На практике обычно пользуются готовыми таблицами, в которых указано, в каких отношениях должны быть взяты компоненты буферных смесей для получения буферных растворов с желаемым значением рН.
Поскольку константа электролитической диссоциации К при данных условиях постоянна, рН буферного раствора будет зависеть только от отношения концентраций кислоты (или основания) и соли, взятых для приготовления буферной смеси, и не зависит от абсолютного значения этих концентраций. Поэтому при разбавлении буферных растворов концентрация водородных ионов (рН) должна оставаться неизменной. Опыт показывает, что даже значительное разбавление буферных растворов в 10—20 раз и более мало отражается на их рН.
Способность буферных растворов противодействовать резкому изменению рН при прибавлении к ним кислоты или щелочи является ограниченной. Буферная смесь поддерживает рН постоянным только при условии, что количество прибавляемых к раствору сильной кислоты или щелочи не превышает определенной величины. Превышение этого количества вызывает резкое изменение рН, т. е. буферное действие раствора прекращается.
Предел, в котором проявляется буферное действие, называется буферной емкостью. Буферную емкость выражают количеством вещества эквивалента сильной кислоты или основания, которое следует добавить к 1 м3 буферного раствора, чтобы сместить рН на единицу, т. е.
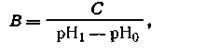
| 4.81 |
где В — буферная емкость, С — количество сильной кислоты или основания, кмоль; рН0— водородный показатель до добавления сильной кислоты или основания; pH1 — водородный показатель после добавления кислоты или щелочи.
Величина буферной емкости зависит от концентрации компонентов буферной смеси и отношения между этими концентрациями.
Зная сущность механизма действия буферных систем, нетрудно догадаться, что наибольшей буферной емкостью обладают растворы, содержащие большие концентрации входящих в состав буфера компонентов, и растворы, составленные из компонентов, взятых в равных количествах. Влияние величины соотношения компонентов буферных смесей на их емкость связано с тем, что при равных величинах числителя и знаменателя величина дроби наиболее устойчива к изменению своего числового значения. Поэтому и величина соотношения компонентов, входящих в состав буфера, будет меньше подвержена изменениям.
Таким образом, буферные растворы обладают следующими свойствами:
1) концентрация водородных ионов буферных смесей мало зависит от разбавления;
2) добавление к буферным смесям небольших количеств (в пределах буферной емкости растворов) кислоты или щелочи мало изменяет рН;
3) величина буферной емкости зависит от концентрации компонентов буферной смеси и от отношения между этими компонентами.
Дата добавления: 2016-02-20; просмотров: 11609;
