Водные буферные растворы
Растворы, рН которых относительно мало изменяется при добавлении небольших количеств кислоты или основания, называются буферными растворами.
Они обычно содержат либо слабую кислоту и её соль, например, CH3COOH + NaCH3COO, либо слабое основание и его соль, например, NH4OH + NH4Cl.
В смесях водных растворов слабых кислот и их солей, а также в смесях слабых оснований и их солей концентрации ионов Н+ и ОН- зависят не от абсолютных количеств, а от соотношений кислоты или основания и их солей.
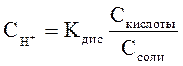 ; (45)
; (45)
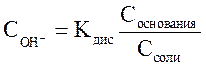 . (46)
. (46)
Это значит, что Сн+ (и рН) в таких смесях не зависит от разбавления.
Рассмотрим процессы диссоциации в растворе слабой кислоты и её соли: CH3COOH ⇄  CH3COO- + H+,
CH3COO- + H+,
CH3COONa → CH3COO- + Na+.
При добавлении к буферной смеси небольших количеств сильной кислоты анионы CH3COO- стягиваются в молекулы слабой кислоты по реакции:
CH3COO- + Н+ ⇄ CH3COOН.
При добавлении в буферный раствор небольших количеств щелочи произойдет образование слабого электролита – воды:
ОН- + Н+ ⇄ Н2О
Образование слабых электролитов при добавлении в буферный раствор кислоты или основания обусловливает устойчивость рН.
При необходимости с помощью буферных смесей можно поддерживать рН растворов на нужном практически постоянном уровне.
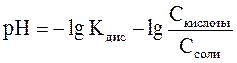 ; (47)
; (47)
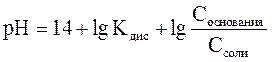 , (48)
, (48)
где Kдис - константа диссоциации слабой кислоты или слабого основания.
Дата добавления: 2016-02-24; просмотров: 1350;
