Количественные характеристики процессов растворения
Способность твердого вещества переходить в раствор не беспредельна. Первые порции вещества при введении в растворитель полностью растворяются, и образуется ненасыщенный раствор. В нём возможно растворение следующих порций до тех пор, пока вещество не перестанет переходить в раствор, и часть его останется в виде осадка. Такой раствор называют насыщенным.
Между веществом в насыщенном растворе и веществом в осадке устанавливается состояние гетерогенного равновесия (∆Gрастворения = 0). Частицы растворенного вещества переходят через поверхность раздела из жидкой фазы (раствора) в твердую фазу (осадок) и обратно, поэтому состав насыщенного раствора остается постоянным при данной постоянной температуре.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является содержание его в насыщенном растворе, что также принято называть растворимостью – СР, (выражается в граммах растворенного вещества на 100 г растворителя или в моль/л).
Раствор называется насыщенным, если он находится в равновесии с растворяемым веществом: ∆Gрастворения = 0.
В насыщенном растворе содержится предельное при данных условиях количество вещества, и концентрация раствора С 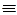 Ср.
Ср.
Ненасыщенный раствор содержит меньше вещества, чем это определяется его растворимостью: С < Ср , и для него ∆Gрастворения <0.
Пересыщенный раствор содержит больше вещества, чем соответствует его растворимости, т.е. С > Ср , и для него ∆Gрастворения > 0.
По растворимости при T = const различают:
- хорошо растворимые вещества (образуют насыщенные растворы с концентрацией более 0,1 моль/л);
- малорастворимые вещества (образуют насыщенные растворы с концентрацией 0,1 – 0,001 моль/л);
- практически нерастворимые вещества (образуют насыщенные растворы с концентрацией менее 0,001 моль/л).
В насыщенных растворах малорастворимых сильных электролитов имеет место гетерогенное равновесие между твердой фазой – осадком малорастворимого вещества KtmAnn(тв.) - и жидкой фазой – раствором, содержащим гидратированные ионы Ktn+∙ aq и Anm-∙ aq растворенной части электролита:
KtmAnn(ТВ.) + aq ⇄ mKtn+∙ aq + nAnm-∙ aq. (49)
Константа равновесия для данного процесса равна:
Краств. = 
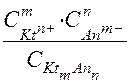 ,
,
где 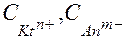
 - равновесные концентрации ионов электролита в растворе,
- равновесные концентрации ионов электролита в растворе, 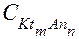 - равновесная концентрация твердого вещества в осадке, которая практически постоянна. Поэтому можно считать, что:
- равновесная концентрация твердого вещества в осадке, которая практически постоянна. Поэтому можно считать, что:
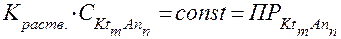 .
.
Если вещество малорастворимо, можно принять коэффициент активности 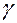 ≈ 1 и в уравнении (50) использовать не активности участников реакции гетерогенного равновесия, а их равновесные концентрации.
≈ 1 и в уравнении (50) использовать не активности участников реакции гетерогенного равновесия, а их равновесные концентрации.
Следовательно произведение концентраций (или активностей) ионов в степенях их стехиометрических коэффициентов есть величина постоянная для данной температуры, называемая произведением растворимости (ПР)
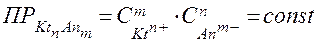 (при Т=const) .
(при Т=const) .
Значение ПР является критерием для разделения электролитов на хорошо и малорастворимые. Условный критерий хорошо растворимых электролитов - ПР ³ 10-2 моль/л, малорастворимых электролитов - ПР<10-2 моль/л.
Произведения растворимости практически для всех малорастворимых веществ можно найти в справочной литературе. В таблицах 17 – 19 приведены значения ПР для малорастворимых кислот, оснований и солей соответственно.
Таблица 17
Произведения растворимости малорастворимых кислот при 298 K
| Группа в П.С.Э. | Кислота | ПР | Группа в П.С.Э. | Кислота | ПР | |
| III A | HAlO2 | 1,0·10-13 | IV B | H2TiO3 | 1,0·10-29 | |
| IV A | H2GeO3 | 1,1·10-11 | H2TiO4 | 3,6·10-17 | ||
| H4GeO4 | 1,5·10-11 | H2ZrO3 | 3,2·10-26 | |||
| H2SnO2 | 4,6·10-15 | VI B | H2MoO4 | 5,8·10-5 | ||
| H2SnO3 | 1,0·10-57 | H2Mo2O7 | 1,5·10-7 | |||
| H2PbO2 | 1,0·10-20 | H2WO4 | 1,2·10-6 |
Таблица 18
Произведения растворимости малорастворимых оснований при 298 K
| Группа в П.С.Э. | Основание | ПР | Группа в П.С.Э. | Основание | ПР | |
| I A | LiOH | 4,0·10-2 | III B | Ac(OH)3 | 2,1·10-19 | |
| NaOH | 4,0·10-2 | Am(OH)3 | 2,7·10-20 | |||
| II A | Be(OH)2 | 1,6·10-21 | Am(OH)4 | 1,1·10-56 | ||
| Mg(OH)2 | 1,8·10-11 | Ce(OH)3 | 4,5·10-25 | |||
| Ca(OH)2 | 5,5·10-6 | Ce(OH)4 | 1,6·10-56 | |||
| Sr(OH)2 | ~10-6 | Pu(OH)3 | 2,0·10-20 | |||
| Ba(OH)2 | ~10-6 | Pu(OH)4 | 1,0·10-52 | |||
| III A | Al(OH)3(осн.) | 1,1·10-33 | IV B | TiO(OH)2 | 1,0·10-29 | |
| Al(OH)3(кисл.) | 1,0·10-13 | Zr(OH)4 | 1,1·10-54 | |||
| Ga(OH)3 | 5,0·10-37 | Hf(OH)4 | 4,0·10-26 | |||
| In(OH)3 | 6,3·10-34 | V B | VO(OH)2 | 7,4·10-23 | ||
| Tl(OH)3 | 1,4·10-53 | VI B | Cr(OH)2 | 1,0·10-17 | ||
| IV A | Ge(OH)4 | 1,1·10-57 | Cr(OH)3 | 6,3·10-31 | ||
| Sn(OH)2 | 1,4·10-27 | W(OH)4 | 1,0·10-50 | |||
| Sn(OH)4 | 1,0·10-57 | VII B | Mn(OH)2 | 1,6·10-13 | ||
| Pb(OH)2 | 1,0·10-20 | Mn(OH)4 | 1,0·10-56 | |||
| V A | Sb(OH)3 | 4,0·10-42 | VIII B | Fe(OH)2 | 7,9·10-16 | |
| Bi(OH)3 | 4,8·10-31 | Fe(OH)3 | 3,7·10-40 | |||
| BiOOH | 4,0·10-10 | Co(OH)2 | 2,0·10-16 | |||
| I B | Cu(OH)2 | 2,2·10-20 | Co(OH)3 | 1,0·10-43 | ||
| AgOH | 1,6·10-8 | Ni(OH)2 | 3,2·10-16 | |||
| AuOH | 7,9·10-20 | Ni(OH)3 | 6,3·10-18 | |||
| Au(OH)3 | 8,5·10-46 | Ru(OH)3 | 1,0·10-36 | |||
| II B | Zn(OH)2 | 1,3·10-17 | Rh(OH)3 | 2,0·10-18 | ||
| Cd(OH)2 | 4,0·10-15 | Ir(OH)4 | 1,6·10-72 | |||
| Hg2(OH)2 | 1,6·10-23 | Pt(OH)2 | 1,0·10-35 | |||
| Hg(OH)2 | 3,0·10-26 | Pt(OH)4 | 1,6·10-72 | |||
| III B | Sc(OH)3 | 2,0·10-30 | Pd(OH)2 | 1,0·10-31 | ||
| Y(OH)3 | 1,5·10-23 | Pd(OH)4 | 6,5·10-71 | |||
| La(OH)3 | 2,0·10-19 |
Таблица 19
Произведения растворимости малорастворимых солей при 298 K
| Группа в П.С.Э. | Соль | ПР | Группа в П.С.Э. | Соль | ПР | |
| I A | Li2CO3 | 4,0·10-3 | III A | AlPO4 | 5,8·10-19 | |
| Li3PO4 | 3,2·10-9 | Tl3PO4 | 6,7·10-8 | |||
| NaIO4 | 3,0·10-3 | Tl2S | 5,0·10-21 | |||
| KClO4 | 1,1·10-2 | Tl2SO3 | 6,3·10-4 | |||
| KIO4 | 8,3·10-4 | Tl2SO4 | 4,0·10-3 | |||
| K2SiF6 | 8,7·10-7 | IV A | GeS | 3,0·10-35 | ||
| CsClO4 | 4,0·10-3 | SnI2 | 1,0·10-4 | |||
| CsIO4 | 4,4·10-3 | SnS | 1,0·10-25 | |||
| II A | BeCO3 | 1,0·10-3 | PbCO3 | 7,5·10-14 | ||
| MgCO3 | 2,1·10-5 | PbCl2 | 1,6·10-5 | |||
| MgF2 | 6,5·10-9 | PbCrO4 | 1,8·10-14 | |||
| Mg3(PO4)2 | 1,0·10-13 | PbF2 | 2,7·10-8 | |||
| MgSO3 | 3,0·10-3 | PbI2 | 1,1·10-9 | |||
| CaCO3 | 4,8·10-9 | PbMoO4 | 4,0·10-6 | |||
| CaCrO4 | 7,1·10-4 | Pb3(PO4)2 | 7,9·10-13 | |||
| CaF2 | 4,0·10-11 | PbS | 2,5·10-27 | |||
| Ca3(PO4)2 | 2,0·10-29 | PbSO4 | 1,6·10-8 | |||
| CaSO3 | 1,3·10-8 | V A | Sb2S3 | 1,6·10-93 | ||
| CaSO4 | 9,1·10-6 | BiI3 | 8,1·10-19 | |||
| SrCO3 | 1,1·10-10 | BiPO4 | 1,3·10-23 | |||
| SrCrO4 | 3,6·10-5 | Bi2S3 | 1,0·10-97 | |||
| SrF2 | 2,5·10-9 | I B | CuBr | 5,3·10-9 | ||
| Sr3(PO4)2 | 1,0·10-31 | CuCO3 | 2,5·10-10 | |||
| SrSO3 | 4,0·10-8 | CuCl | 1,2·10-6 | |||
| SrSO4 | 3,2·10-7 | CuCrO4 | 3,6·10-6 | |||
| SrMoO4 | 2,0·10-4 | CuI | 1,1·10-12 | |||
| BaCO3 | 5,1·10-9 | CuS | 6,3·10-36 | |||
| BaCrO4 | 1,2·10-10 | Cu2S | 2,5·10-48 | |||
| BaF2 | 1,1·10-6 | AgBr | 5,3·10-13 | |||
| Ba(NO3)2 | 4,5·10-3 | Ag2CO3 | 8,2·10-12 | |||
| Ba3(PO4)2 | 6,0·10-39 | AgCl | 1,8·10-10 | |||
| BaSO3 | 8,0·10-7 | Ag2CrO4 | 1,1·10-12 | |||
| BaSO4 | 1,1·10-10 | AgI | 8,3·10-17 | |||
| BaMoO4 | 4,0·10-8 | AgNO2 | 1,6·10-4 |
| I B | Ag3PO4 | 1,3·10-20 | IV B | Zr3(PO4)4 | 1,0·10-132 | |
| Ag2S | 6,3·10-50 | V B | (VO)3(PO4)2 | 8,0·10-25 | ||
| Ag2SO3 | 1,5·10-14 | VI B | CrPO4 | 1,0·10-17 | ||
| Ag2SO4 | 1,6·10-5 | VII B | MnCO3 | 1,8·10-11 | ||
| AuBr | 5,0·10-17 | MnS | 2,5·10-10 | |||
| AuBr3 | 4,0·10-36 | VIII B | FeCO3 | 3,5·10-11 | ||
| AuCl | 2,0·10-13 | FePO4 | 1,3·10-22 | |||
| AuCl3 | 3,2·10-25 | FeS | 5,0·10-18 | |||
| AuI | 1,6·10-23 | CoCO3 | 1,4·10-13 | |||
| AuI3 | 1,0·10-46 | NiCO3 | 1,3·10-7 | |||
| II B | ZnCO3 | 1,5·10-11 | IrS2 | 1,0·10-75 | ||
| Zn3(PO4)2 | 9,1·10-33 | PtBr4 | 3,0·10-11 | |||
| ZnS | 1,6·10-24 | PtCl4 | 8,0·10-29 | |||
| CdCO3 | 5,2·10-12 | PtS | 8,0·10-73 | |||
| CdS | 7,9·10-27 | |||||
| HgS | 1,6·10-52 | |||||
| III B | La2S3 | 2,0·10-13 | ||||
| La2(SO4)3 | 3,0·10-5 | |||||
| Pu(IO3)4 | 5,0·10-13 |
Растворимость вещества СР (моль/л) связана с П.Р. соотношением
СР= 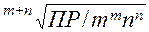 (табл.20). (52)
(табл.20). (52)
Таблица 20
Соотношение между растворимостью и ПР
| Общая формула вещества | Частные формулы веществ | Формула пересчета |
| KtAn | AgCl,CaCO3,BaMnO4, | 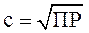
|
| Kt2An RtAn2 | Ag2CrO4, Ag2SO4, HgCl2 | 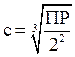
|
| Kt3An KtAn3 | Ag3PO4, Cu3BO3 Au(NO2)3 | 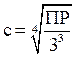
|
| Kt2An3 Kt3An2 | Zn2S3, Tl2(SO4)3, Ba3(PO4)2, Ca3(BO3)2 | 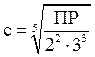
|
Растворимость некоторых кислот, оснований и солей в воде при 298 K приведена в табл.21.
Таблица 21
Растворимость некоторых кислот, оснований, и солей в воде при 298 K
| H+ | (NH4)+ | Na+ | K+ | Ba2+ | Ca2+ | Mg2+ | Al3+ | Cr3+ | |
| F- | Р | Р | Р | Р | М | М | М | Р | Р |
| Cl- | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Br- | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| I- | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| (OH)- | Р | Р | Р | Р | Р | М | М | М | М |
| (NO3)- | Р | Р | Р | Р | М | Р | Р | Р | Р |
| S2- | Р | Р | Р | Р | Р | М | Р | - | - |
| (SO3)2- | - | - | Р | Р | М | М | М | - | - |
| (SO4)2- | Р | Р | Р | Р | М | М | Р | Р | Р |
| (PO4)3- | Р | Р | Р | Р | М | М | М | М | М |
| (SiO3)2- | М | - | Р | Р | М | М | М | М | М |
| (CO3)2- | Р | Р | Р | М | М | М | - | - | М |
| (CH3COO)- | Р | Р | Р | Р | Р | Р | Р | М | Р |
Продолжение табл. 20
| Fe3+ | Fe2+ | Mn2+ | Zn2+ | Ag+ | Hg22+ | Hg2+ | Cu2+ | Pb2+ | Bi3+ | Sn2+ |
| Р | М | М | М | Р | М | М | М | М | М | Р |
| Р | Р | Р | Р | М | М | Р | Р | М | - | Р |
| Р | Р | Р | Р | М | М | М | М | М | - | Р |
| - | Р | Р | Р | М | М | М | - | М | - | М |
| М | М | М | М | - | - | - | М | М | М | М |
| Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| - | М | М | М | М | М | М | М | М | М | М |
| - | М | М | М | М | М | М | М | М | М | М |
| Р | Р | Р | Р | М | М | Р | Р | М | Р | Р |
| М | М | М | М | М | М | М | М | М | М | М |
| М | М | М | М | М | - | - | М | М | - | М |
| М | М | М | М | М | М | М | М | М | М | - |
| Р | Р | Р | Р | Р | М | Р | Р | Р | Р | Р |
Примечание: Абсолютно нерастворимых веществ в воде не существует. Поэтому в таблице указаны два индекса: “Р” - вещество растворимо в воде (П.Р.≥10-2), “М” - вещество малорастворимо в воде (П.Р.<10-2). Знак “-” может означать, что вещество разлагается вследствие термической неустойчивости (H2CO3→CO2+H2O; 2AgOH→Ag2O+H2O) или в результате полного гидролиза (Al2S3+6H2O→2Al(OH)3+H2S) и др. 
Таким образом, зная ПР, можно рассчитать растворимость СР, и наоборот.  Задача4.1.
Задача4.1.
Определите растворимость (СР) соли Са3(РО4)2 в г/л, если справочная величина её ПР = 2∙10-29 (при Т=298 К).
Решение.Уравнение гетерогенного равновесия для Са3(РО4)2 (тв)
Са3(РО4)2(тв) + aq ⇄ 3Ca2+aq + 2PO43-aq.
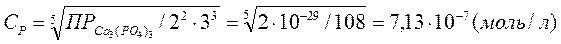 ;
;
молярная масса Са3(РО4)2 М = 310 г/моль;
СР (в г/л) = 7,13 ∙10-7 ∙310 = 2,2∙10-4 г/л. 


Ответ: Ср = 2,2∙10-4 г/л.
Задача 4.2.
Определите ПР соли Ag2SO4, если справочная величина СР = 7,9 г/л (при Т= 298 К).
Решение.  Молярная масса соли Ag2SO4 = 312 г/моль.
Молярная масса соли Ag2SO4 = 312 г/моль.
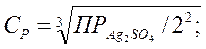
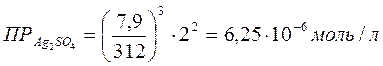 .
.
Ответ: ПР = 6,25∙10-4.
Задача 4.3.
Рассчитайте растворимость соединения BaF2: 1) в воде; 2) в 0,1 М растворе NaF, если ПР(ВаF2) = 1,1∙10-6.
Решение. 1). Учитывая относительно малую величину П.Р. при отсутствии других ионов, в первом приближении можно считать активности ионов Ва2+ и F- равными их концентрациям. Из уравнения диссоциации сильного электролита :
BaF2 (тв) 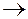 Ba2+ + 2 F-
Ba2+ + 2 F-
следует, что равновесные концентрации ионов в растворе равны:
[Ва2+] = СР и [F- ] = 2 CР.
Тогда по определению 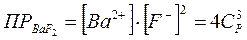 .
.
Отсюда 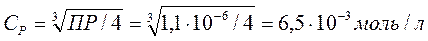 .
.
Ответ: в воде Ср = 6,5∙10-3 моль/л .
2) В насыщенном растворе малорастворимого электролита концентрации ионов, его составляющих, могут меняться только таким образом, чтобы произведение растворимости ПР = const (при Т=const).
Следовательно, при увеличении концентрации (активности) одного из ионов путем введения в раствор хорошо растворимой соли, содержащей данный ион, концентрация (активность) другого иона резко снизится. При этом растворимость (Ср) электролита в целом определяется концентрацией иона, присутствующем в меньшем количестве.
В нашем случае
активность ионов F- в 0,1 М растворе NaF: αF- = gF-∙ [F-] = 0,8∙10-2; а активность ионов Ва2+:αВа2+ =g∙[Ва2+] = ПР/(αF-)2 = 1,1∙10-6/(0,8∙10-2)2 = 1,1∙10-6/6,4∙10-3 = 1,7∙10-4 моль/л.
Следовательно, растворимость малорастворимой соли уменьшается в присутствии хорошо растворимого электролита, содержащего общий ион с этой солью.
Дата добавления: 2016-02-24; просмотров: 1296;
