Ионообменные реакции в водных растворах
Электролитов
Обменные реакции в растворах электролитов относятся к реакциям, протекающим без обмена электронами между частицами и без изменения степеней окисления элементов. Необходимым условием протекания обменных реакций в растворах электролитов является удаление из раствора тех или иных ионов вследствие образования малодиссоциирующих соединений (слабых электролитов и комплексных частиц), малорастворимых соединений (осадков или газов) или более устойчивых в данной среде других ионов.
В растворах электролитов реакции идут между ионами, поэтому суть ионообменных реакций отражают ионные, а не молекулярные реакции.
В ионном уравнении все сильные хорошо растворимые электролиты записывают в виде ионов, в виде молекул записывают только слабые электролиты, малорастворимые и газообразные вещества.
Пример 5.1.
Ионообменные реакции , сопровождаемые выпадением осадка малорастворимого вещества.
а) NaCl + AgNO3 = AgCl(ТВ.) + NaNO3 - молекулярное уравнение;
ПРAgCl = 1,8∙10-10 << 10-2;
Na+ + Cl- + Ag+ + NO3- = AgCl(ТВ.) + Na+ + Cl - ионное уравнение.
Исключая из ионного уравнения ионы, не участвовавшие в реакции (Na+,Cl- ,NO3), получаем краткое ионное уравнение:
Ag+ + Cl- = AgCl(ТВ.) ,
отражающее суть данной практически необратимой обменной реакции.
б) Al2 (SO4)3 + 6 NaOH = 2 Al(OH)3(ТВ.) + 3 Na2SO4;
ПРAl(OH)3 = 1,9∙10-33<< 10-2;
2 Al3+ + 3 (SO4)2- + 6 Na+ + 6 OH- = 2 Al(OH)3 + 6 Na+ + 3(SO4)2-;
Al3+ + 3 (OH)- = Al(OH)3(ТВ).
в) Na2Mo2O7 + HCl = 2 NaCl + H2Mo2O7(ТВ) ;

 1,5∙10-7 < 10-2;
1,5∙10-7 < 10-2;
2 Na+ + (Mo2O7)2- + 2 H+ + 2 Cl- = H2Mo2O7(ТВ) + 2 Na+ + 2 Cl-;
2 H+ + (Mo2O7)2- = H2Mo2O7(ТВ).
Пример 5.2.
Ионообменные реакции, обусловленные образованием газообразных веществ.
a) Na2CO3 + 2 HNO3 = CO2(Г) + Н2О + 2 NaNO3;
2 Na+ + CO32- + 2 H+ + 2 NO3- = CO2(Г) + Н2О + 2 Na+ + 2NO3 –;
CO32- + 2 H+ = CO2(Г) + Н2О.
б) Na2S + 2 HCl = H2S(Г) + 2 NaCl;
2 Na+ + S2- + 2 H+ + 2 Cl- = Н2S(Г) + 2 Na+ + 2 Cl-;
2 H+ + S2- + = Н2S(Г).
Пример 5.3.
Ионообменные реакции с образованием слабых электролитов.
а) Все реакции между кислотами и основаниями (реакции нейтрализации) сопровождаются образованием слабого электролита воды.
 1,8∙10-16.
1,8∙10-16.
Эти реакции идут практически необратимо.
Н2SO4 + KOH = K2SO4 + Н2O.
2 H+ + SO4-2 + K+ + OH- = Н2O + 2 K+ + (SO4) 2-.
H+ + OH- = Н2O.
б) NH4NO3 + KOH = NH4OH + KNO3
- в данной реакции образуется слабый электролит – слабое основание гидроксид аммония .
 ;
;
NH4+ + NO3- + К+ + ОН- = NH4OН + К+ + NO3-;
NH4+ + ОН- = NH4OН.
в) СН3СООNa + HCl = СН3СООH + NaCl
- реакция сопровождается образованием слабого электролита – слабой уксусной кислоты.
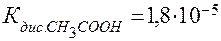 ;
;
СН3СОО- + Na+ + H+ + Cl- = СН3СООH + Na+ + Cl-;
H+ + СН3СОО- = СН3СООH.
Пример 5.4.
Ионообменные реакции с образованием в данной среде более устойчивых ионов.
В кислой среде устойчивы ионы Cr2O72-, а растворы дихроматов имеют оранжевую окраску. В щелочной и нейтральной средах более устойчив ион хромата (CrO4)-2, а растворы хроматов имеют желтый цвет.
(Cr2O7 ) 2- ⇄ (CrO4)-2
рН < 7 pH ≥ 7
оранж. цвет желт. цвет
2 К2CrO4 + 2 HCl = K2Cr2O7 + H2O + 2 KCl;
4 K+ + 2 (CrO4)-2 + 2 H+ + 2 Cl- = (Cr2O7 )2- + H2O + 4 K+ + 2 Cl-;
2 H+ + 2 (CrO4)-2 = (Cr2O72) + H2O.
В реакции образуется также слабый электролит – вода.
Пример 5.5.
Ионообменные реакции, сопровождающиеся растворением осадка.
а) Малорастворимые кислоты можно растворить в растворах щелочей:
H2WO4(ТВ) + KOH = K2WO4 + H2O;
H2WO4(ТВ) + OH- = (WO4)2- + H2O.
б) Малорастворимые основания можно растворить в растворах сильных кислот:
Fe(OH)3(ТВ) + 3 HCl = FeCl3 + 3 H2O;
Fe(OH)3(ТВ) + 3H+ = Fe3+ + 3 H2O.
Обе реакции идут с образованием слабого электролита – воды.
в) Малорастворимые соли можно растворить в результате реакций комплексообразования :
AgCl(ТВ,) + 4 NH3 = [Ag(NH3)4]Cl.
Дата добавления: 2016-02-24; просмотров: 1411;
