Условие выпадения и растворения осадков в водных растворах электролитов
В лабораторной и аналитической практике часто приходится решать такие задачи как: а) приготовление раствора малорастворимого вещества заданной концентрации; б) растворение навески вещества в минимальном объеме воды; в) определение условий выпадения в осадок продукта реакции; г) выбор оптимального способа растворения осадка.
Эти и другие подобные задачи можно легко решить, используя справочные величины ПР и применяя правило выпадения осадка электролита , илианалитическое правило ПКИ (ПАИ).
ПКИ (ПАИ) – это стехиометрическое произведение реальных концентраций (активностей) ионов малорастворимого электролита, рассчитанных или определенных аналитически. По форме ПКИ аналогично ПР, но отличается от него тем, что в ПР входят равновесные концентрации ионов электролита, соответствующие состоянию насыщенного раствора, а в ПКИ – реальные концентрации ионов, которые могут отличаться от равновесных в ту или иную сторону.
Правило выпадения осадка электролита:
Если ПКИ 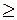 ПР, то раствор насыщен по данному веществу –электролиту и оно выпадает в осадок.
ПР, то раствор насыщен по данному веществу –электролиту и оно выпадает в осадок.
Если ПКИ 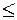 ПР, то раствор ненасыщен по данному веществу - электролиту, и осадок не образуется.
ПР, то раствор ненасыщен по данному веществу - электролиту, и осадок не образуется.
Задача 4.4.
Определите, можно ли приготовить раствор Са(ОН)2 с концентрацией С=0.002 моль/л, если при 25о С ПРСа(ОН)2 = 6∙10-6.
Решение.Исходя из уравнения диссоциации:
Са(ОН)2 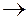 Са2+ + 2 ОН-,
Са2+ + 2 ОН-,
определяем молярную концентрацию ионов в растворе.
ССа2+ = ССа(ОН)2 = 2∙10-3 моль/л; СОН- = 2 ССа(ОН)2 = 4∙10-3 моль/л.
Рассчитаем ионную силу раствора:
J = 0,5(CCa2+∙ z2Ca2+ + COH-∙ z2OH-) = 0,5(2∙10-3 ∙ 4 + 4∙10-3×1) = 6∙10-3 .
По правилу ионной силы определим коэффициенты активности ионов в таком растворе по табл. 9:
gСа2+ = gМ2+ ≈ 0,65; gОН- = gА- ≈ 0,95.
Тогда произведение активностей в данном растворе:
ПАИ = α Са2+∙ α2ОН- = ССа2+∙ С2ОН-∙ gСа2+∙ g2ОН- =
2 ∙ 10-3 ∙ 0,61 ∙ (4 ∙ 10-3)2 ∙ (0,93)2 = 1,69∙10-8.
Так как полученная величина ПАИ Са(ОН)2 < ПРСа(ОН)2 , вещество растворится полностью, и раствор 2∙10-3 М можно приготовить.
Следует иметь в виду, что при введении в раствор хорошо растворимого электролита, не имеющего общих ионов с малорастворимым соединением, растворимость последнего повышается, так как при этом уменьшаются коэффициенты активностей ионов, а ПР остается постоянным.
Задача 4.5.
Выпадет ли осадок, если слить 30 см3 CuSO4 с концентрацией 0,02г/250 см3 и 20 см3 раствора Na3AsO4 c концентрацией 3∙104 моль/л ?
Решение.
а) Предполагаемая реакция выпадения осадка:
3 CuSO4 + 2 Na3AsO4 = Cu3(AsO4)(ТВ.) + 3 Na2SO4;
3 Cu2+ + 3 (SO4)2- + 6 Na+ + 2 (AsO4)3- = Cu3(AsO4)2(ТВ.) + 6 Na+ + 3 (SO4)2-.
Гетерогенное равновесие:
3 Cu2+ + 2 (AsO4)3- ⇄ Cu3(AsO4)(ТВ.) .
б) Расчет исходной концентрации ССu2+ , ион-моль/л:
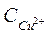 =
= 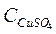 =
= 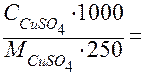
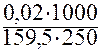 = 5∙10-4 моль/л.
= 5∙10-4 моль/л.
Расчет исходной концентрации 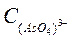 , ион-моль/л:
, ион-моль/л:
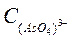 =
= 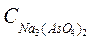 = 3∙10-4 моль/л.
= 3∙10-4 моль/л.
в) При сливании растворы разбавляют друг друга, и концентрации всех компонентов уменьшаются. Объём раствора после сливания
V = 30+20=50 см3.. Рассчитаем концентрации компонентов раствора после сливания:
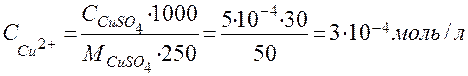 ;
;
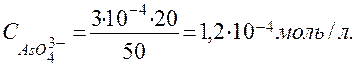
г) Расчет 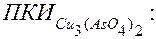
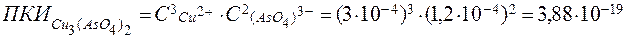 .
.
Справочная величина 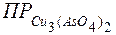 = 7,6 ∙ 10-36 < ПКИ = 3.88 ∙ 10-19 .
= 7,6 ∙ 10-36 < ПКИ = 3.88 ∙ 10-19 .
Ответ: Раствор насыщен по веществу Cu3(AsO4)2 , и оно выпадет в осадок.
Дата добавления: 2016-02-24; просмотров: 2170;
