Гидролиз соли по аниону
Рассмотрим гидролиз соли, образованной сильным основанием и слабой кислотой, например, КF. Реакция полной диссоциации соли:
КF ⇄ K+ + F-.
Гидролизу подвергается анион слабой кислоты F-:
F- + H2O ⇄ HF + OH-.
Суммарная реакция гидролиза в молекулярном виде:
КF + H2O⇄ HF + КОН .
Из уравнения реакции гидролиза следует, что в растворе появляется некоторое избыточное количество гидроксил-ионов, т.е. раствор подщелачивается. Степень гидролиза β и константа гидролиза КГ в данном случае описываются теми же уравнениями, как и в предыдущих примерах (п.6.1.), но вместо константы диссоциации слабого основания входит константа диссоциации слабой кислоты.
Равновесную концентрацию ионов ОН- вычисляем из уравнения:
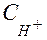 = β∙СAn =
= β∙СAn = 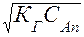 . (67)
. (67)
Соответственно, водородный показатель среды рассчитывается по уравнению:
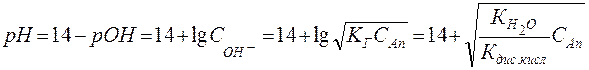 (68)
(68)
Следовательно, гидролиз соли, образованной сильным основанием и слабой кислотой, идет по аниону и приводит к подщелачиванию раствора. рН среды вычисляется по формуле:
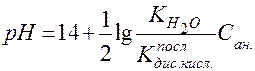 , (69)
, (69)
где 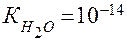 ;
; 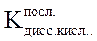 –- последняя константа диссоциации слабой кислоты (справочная величина); Cан., моль/л – исходная концентрация анионов соли.
–- последняя константа диссоциации слабой кислоты (справочная величина); Cан., моль/л – исходная концентрация анионов соли.
Пример 6.2
10 г соли Na3PO4 растворили в 1000 см3 воды. Чему равна величина pH раствора?
| |

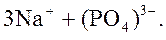
Na+ “наследует” свойства сильного основания NaOH (Кдисс. > 10−2),
(PO4)3− “наследует” свойства слабой кислоты H3PO4 (Кдисс.< 10−2).
|


|
|
|
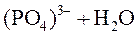 ⇄
⇄ 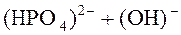 .
.
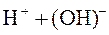

Kдисс.= 1,8∙10−16 KIIIдисс.= 1,3∙10−12 .
Устанавливается положение равновесия влево (в сторону более слабого электролита – воды):
(  <
< 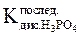 ), то есть [РО43- ] > [НРО42- ].
), то есть [РО43- ] > [НРО42- ].
Ионы Na+ в реакции не участвуют.
Молекулярное уравнение реакции 1-ой стадии гидролиза:
 .
.
(равновесие сдвинуто влево).
Так как в результате реакции гидролиза в растворе появляются свободные ионы (OH)−, то pH > 7 (среда щелочная).
Расчет pH 1-ой стадии гидролиза:
Сг/л = 10 г/л , М = 164 – мольная масса соли Na3PO4.
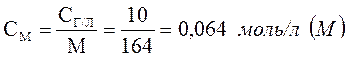 ;
;
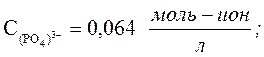
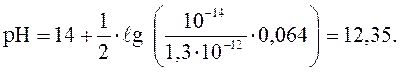
Ответ. рН раствора Na3PO4 заданной концентрации равен 12,35.
Гидролиз соли по аниону можно предотвратить, если растворить соль в заранее подщелоченном растворе. В данном случае, перед растворением соли Na3PO4 в воде, необходимо в воду добавить щелочь NaOH в таком количестве, чтобы величина pH стала больше 12,35. Добавление кислоты в таком количестве, чтобы величина pH стала меньше 12,35 , вызывает сдвиг равновесия вправо, т. е. будет способствовать гидролизу. При нагревании и добавлении кислоты могут протекать последующие стадии гидролиза.
Общее число стадий гидролиза численно равно заряду аниона ( для аниона РО43- возможны 3 стадии гидролиза).
|

|
|
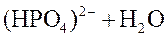
 .
.


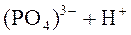
|

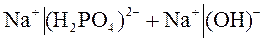 .
.
3-я стадия гидролиза:
|

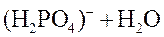 ⇄
⇄ 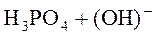 .
.


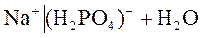 ⇄
⇄ 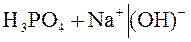 .
.
В данном случае 3-я стадия гидролиза находится в состоянии равновесия, так как образуется хорошо растворимая кислота H3PO4.
Дата добавления: 2016-02-24; просмотров: 1718;
