Равновесия в растворах гидролизующихся солей
Гидролизом солей называют реакции ионного обмена между водой и компонентами растворенных в ней солей, сопровождающиеся образованием малодиссоциированных соединений, газообразных или твердых продуктов. В результате гидролиза в растворе соли может появиться некоторое избыточное количество ионов Н+ или ОН-, т.е. раствор приобретает кислые или основные свойства. Поэтому процесс гидролиза в определенной степени является обратным процессу нейтрализации - взаимодействию кислоты и основания.
Классической реакцией получения солей является взаимодействие основания и кислоты:
|
|
|
|
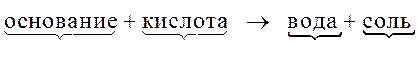 .
.
Соль сохраняет “наследственность” по катиону от основания и по аниону от кислоты.
Все соли – сильные электролиты, т.е. при растворении в воде (aq) соли полностью диссоциируют на гидратированные катионы и анионы. Этот процесс необратим вплоть до насыщенного состояния:
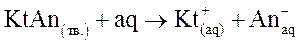 .
.
Любую соль можно представить как продукт взаимодействия основания и кислоты. Исходя из этого, различают 4 типа солей.
1. Соли, образованные сильным основанием и сильной кислотой,
например: KCl, NaNO3, BaCl2. Соли этого типа гидролизу не подвергаются.
2. Соли, образованные слабым основанием и сильной кислотой, например: Zn(NO3)2, FeSO4, NH4Cl. Подвергаются гидролизу по катиону .
3. Coли, образованные слабой кислотой и сильным основанием, например: Na3BO3, KNO2, Na2S. Подвергаются гидролизу по аниону.
4. Соли, образованные слабой кислотой и слабым основанием, например, (NH4)2CO3, Cd(CN)2. Подвергаются полному гидролизу – по катиону и аниону одновременно.
Показателем глубины протекания гидролиза является степень гидролиза (β) – отношение концентрации гидролизованных частиц Сгидр. к исходной концентрации растворенных частиц соли - С:
β = Сгидр./С. (59)
Показателем глубины, а также и направления гидролиза является и рН раствора соли. Поэтому расчет рН раствора соли представляет как практический, так и теоретический интерес.
Механизм гидролиза каждого типа солей имеет свои особенности.
Дата добавления: 2016-02-24; просмотров: 2600;
