Гидролиз соли по катиону
Рассмотрим гидролиз соли, образованнойслабым основанием и сильной кислотой, например NH4NO3. В растворе соль полностью диссоциирована на ионы:
NH4 NO3 = NH4 + + NO3- .
Вода как, слабый электролит, диссоциирована частично:
Н2О ⇄ Н+ + ОН-.
ОН- - ионы взаимодействуя с катионом NH4+ , образуют слабое основание NH4OH:
NH4+ + OH- ⇄ NH4OH.
Суммарная реакция гидролиза в ионном
NH4+ + H2О ⇄ NH4OH + Н+,
и молекулярном виде:
NH4NO3 + H2O⇄ NH4OH + НNO3,
из которой следует, что в результате гидролиза появилось избыточное количество ионов Н+, т.е. среда стала кислой и рН системы понизился (рН < 7).
Как правило, равновесие гидролиза сильно сдвинуто влево, т.е. концентрация негидролизованных частиц в растворе существенно выше концентрации частиц, подвергшихся гидролизу. Степень гидролиза β, как правило, невелика. Это объясняется тем, что продукты гидролиза вступают в обратную реакцию - реакцию нейтрализации с образованием очень слабого электролита – воды.
Согласно закону действующих масс, константа равновесия для уравнения гидролиза имеет вид: 
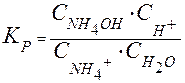 ,
,
или в общем виде для гидролиза катиона слабого основания:
Kt+ + H2O ⇄ KtOH + H+
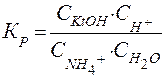 . (60)
. (60)
Так как  - равновесная концентрация воды – практически не меняется при гидролизе, то принимаем ее постоянной и, умножая ее на КР, получаем константу, называемую константой гидролиза - КГ :
- равновесная концентрация воды – практически не меняется при гидролизе, то принимаем ее постоянной и, умножая ее на КР, получаем константу, называемую константой гидролиза - КГ :
КГ = КР∙  =
= 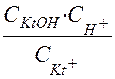 . (61)
. (61)
Выразим равновесную концентрацию ионов водорода 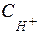 через ионное произведение воды
через ионное произведение воды 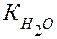 :
:
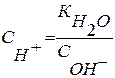
и подставим в выражение для константы гидролиза КГ:
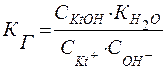 , или
, или 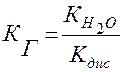 ,
,
где Кдис – константа диссоциации слабого основания KtOH, равная:
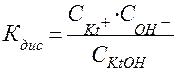 . (62)
. (62)
Чем меньше константа диссоциации слабого основания, тем больше константа гидролиза, тем полнее протекает гидролиз
Для расчета рН раствора соли необходимо рассчитать концентрацию ионов водорода [Н+]. Согласно ионному уравнению гидролиза соли NH4+ + H2О ⇄ NH4OH + Н+.
Концентрация [Н+] = [NН4+], т.е. концентрации гидролизованных частиц Сгидр.. Ее можно выразить через степень гидролиза β:
[Н+] = [NН4+] = β ∙ CKt,
где CKt. – исходная концентрация катионов NH4 +.
Путем несложных преобразований можно убедиться, что степень гидролиза β и константа гидролиза КГ для разбавленных растворов связаны между собой выражением, аналогичным выражению закона разбавления Оствальда:
 . (63)
. (63)
Тогда CH+ = β ∙ CKt = 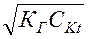 =
= 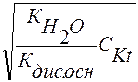 , (64)
, (64)
а рН раствора равно:
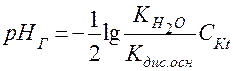 . (65)
. (65)
Следовательно, гидролиз соли, образованной слабым основанием и сильной кислотой, идет по катиону и приводит к подкислению раствора, а рН раствора вычисляется по формуле:
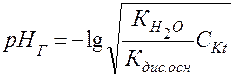 . (66)
. (66)
Пример 6.1
0,05 г соли Al2(SO4)3 растворили в 100 см3 воды. Чему равна величина pH полученного раствора?
Решение. Уравнение электролитической диссоциации соли:
| |
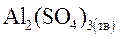 ⇄
⇄ 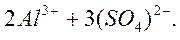
Al3+ “наследует” свойства слабого основания Al(OH)3 (KIдисс.< 10−2);
(SO4)2− “наследует” свойства сильной кислоты H2SO4 (КIдисс.> 10−2).
Если гидролизу подвергается многозарядный катион, то гидролиз может протекать по стадиям, а число стадий гидролиза равно заряду катиона.
Для катиона Al3+ возможны 3 стадии гидролиза.
Ионное уравнение гидролиза по 1-ой стадии:


|
|
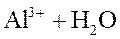 ⇄
⇄ 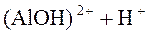 .
.
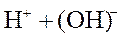
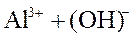
KIдисс.= 1,8∙10−16 , KIIIдисс.= 1,4∙10−9 - это последняя константа диссоциации слабого основания Al(OH)3.
Равновесие реакции сдвинуто влево, в сторону более слабого электролита - воды:
( 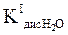 <
<  ), следовательно
), следовательно 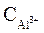 >
> 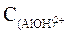 .
.
Ионы (SO4)2− в реакции не участвуют .
Молекулярное уравнение 1-ой стадии гидролиза:
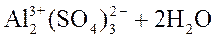 ⇄
⇄ 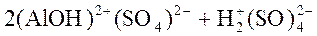 . (равновесие сдвинуто влево)
. (равновесие сдвинуто влево)
Так как в результате реакции гидролиза в растворе появляются свободные ионы Н+, то pH < 7 (среда кислая).
Расчет pH 1-ой стадии гидролиза в растворе Al2(SO4)3.
Необходимо перевести заданную концентрацию соли в мольную:
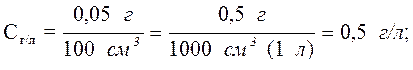
Мольная масса Al2(SO4)3 
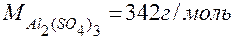 .
.
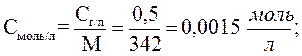
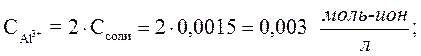
 .
.
Ответ: рН раствора соли Al2(SO4)3 заданной концентрации равен 3,83.
Так как гидролиз соли – реакция эндотермическая, в соответствии с принципом Ле-Шателье о сдвиге равновесия, повышение температуры приводит к увеличению степени гидролиза β. Нагревание способствует гидролизу (сдвигу равновесия вправо). Добавление воды (разбавление раствора) приводит к усилению гидролиза.
Усиление ступенчатого гидролиза солей многокислотного слабого основания и сильной кислоты может привести к образованию малорастворимых основных солей, тогда равновесие гидролиза сильно сдвигается вправо.
Гидролиз соли по катиону можно предотвратить, если растворять соль в заранее подкисленном растворе. В данном случае перед растворением соли Al2(SO4)3 необходимо в воду добавить кислоту H2SO4 в таком количестве, чтобы величина pH стала меньше 3,83.
Добавление щелочи в таком количестве, чтобы величина pH стала больше 3,83 вызовет сдвиг равновесия вправо, т.е. будет способствовать гидролизу. Поэтому при нагревании, разбавлении и добавлении щелочи могут протекать последующие стадии гидролиза.
Как правило, гидролиз идет лишь по первой стадии в силу выше описанных причин. Но если существуют условия для сдвига равновесия реакции гидролиза, то возможно протекание последующих стадий.
2-ая стадия гидролиза
Ионное уравнение 2-ой стадии гидролиза:


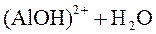 ⇄
⇄ 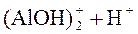 ;
;

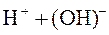
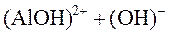
| |
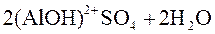 ⇄
⇄ 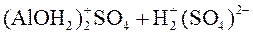 .
.
Расчет рН, β, КГ гидролиза можно провести, руководствуясь теми же представлениями, что и для 1-ой стадии гидролиза.
3-я стадия гидролиза:
|

|
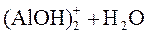
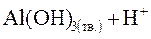 ;
;
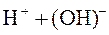
|
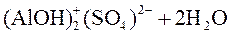
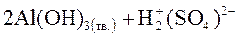 .
.
В данном случае 3-я стадия гидролиза идет до конца, так как образуется малорастворимое соединение Al(OH)3.
Дата добавления: 2016-02-24; просмотров: 1741;
