Примеры вычисления рН среды в растворах кислот и оснований
Задача 3.1.
Концентрация HСl в растворе равна 0,36 г/л. Рассчитайте pH среды.
Решение. Рассчитаем молярную массу HCl и мольную концентрацию раствора СМ по формуле (34 ). HCl - сильный электролит, поэтому для расчета рН применим формулу (36 ):
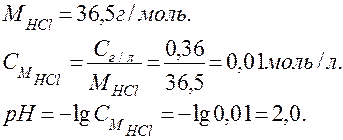 .
.
Ответ: рН = 2,0
Рассчитаем рН в 0,01 M растворе соляной кислоты с учетом коэффициентов активности ионов H+ и Cl - и ионной силы раствора.
Согласно уравнению (17) ионная сила раствора 0,01 М HCl равна:

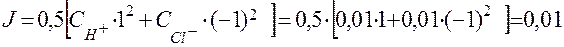
В соответствии с уравнением (19) коэффициенты активности ионов H+ и Сl – равны:
lg g± = -0,509ôz+z-ô 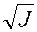 = -0,509•12
= -0,509•12 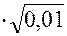 = -0,0509;
= -0,0509;
g± = g(Н+) = g(Cl-) = 0,89.
С учетом значений коэффициентов активности значение рН равно:
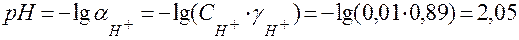 .
.
Сравнение значений рН, вычисленных с использованием концентраций и активностей показывает, что для 0,01 М раствора HCl они достаточно близки. Их отличие не превышает ошибки экспериментального измерения pH (±0,05). Следовательно, влиянием ионной силы на рН в разбавленных растворов можно пренебречь.
В более концентрированных растворах различия становятся заметными, а теоретический расчет коэффициента активности сильно усложняется. Поэтому на практике во всех расчетах, кроме наиболее ответственных, вместо активностей применяют концентрации, пренебрегая некоторой ошибкой.
Задача 3.2.
Концентрация H3PO4 в растворе равна 0,6 моль/л. Рассчитайте pH.
Решение.
Н3РО4 – слабая кислота: 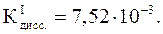
рН находим по формуле (37):
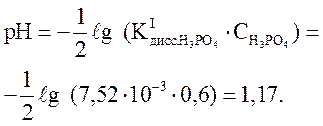
Ответ: рН = 1,17.
Задача 3.3.
Величина pH раствора HNO3 равна 3,5. Рассчитайте 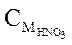 .
.
Решение. HNO3 – сильная кислота.
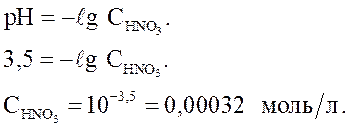
Ответ: СМ = 3,2∙10-4 моль/л.
Задача 3.4.
Величина pH раствора Н3ВО3 равна 5. Рассчитайте 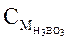 .
.
Решение.
Н3ВО3 – слабая кислота: 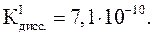
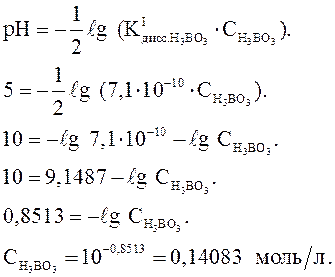
Ответ: СМ = 0,141 моль/л.
Задача 3.5.
Концентрация NaOH в растворе равна 3,5 г/л. Рассчитайте pH среды.
Решение. NaOH – сильное основание:
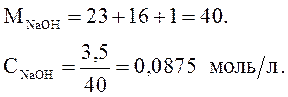
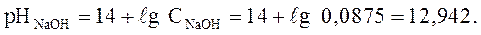
Ответ : рН = 12,94.
Задача 3.6.
Концентрация Mg(OH)2 в растворе равна 0,2 г/л. Рассчитайте pH среды.
Решение.
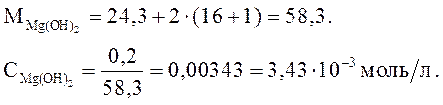
Mg(OH)2 – слабое основание: 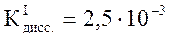 .
.
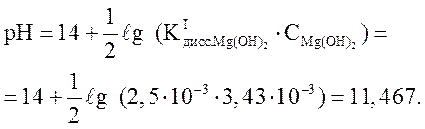
Ответ: рН = 11,47.
Задача 3.7.
Величина pH раствора Ca(OH)2 равна 9. Рассчитайте 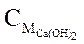 .
.
Решение. Са(ОН)2 – сильный электролит.
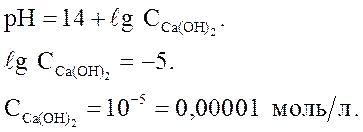
Ответ: СМ = 10-5 моль/л.
Дата добавления: 2016-02-24; просмотров: 5118;
