Электролитическая диссоциация воды. Ионное произведение воды. Показатель среды рН
|

Вода - очень слабый амфотерный электролит, при ее диссоциации образуется одинаковое число ионов Н+ и ОН- , согласно уравнению:
Н2О ⇄ Н+ + ОН - . (26)

В соответствии с законом действующих масс, константа равновесия этого процесса равна:
| |
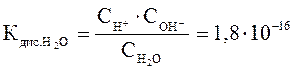 (при t = 250C) , (27)
(при t = 250C) , (27)
где 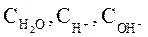 – равновесные концентрации ионов водорода, гидроксила и воды соответственно.
– равновесные концентрации ионов водорода, гидроксила и воды соответственно.
Если учесть, что 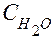 - количество молей воды в 1 л (1000 г) воды равно:
- количество молей воды в 1 л (1000 г) воды равно:
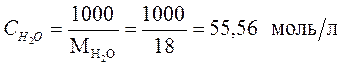 , (28)
, (28)
где 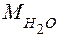 = 18 г/моль – мольная масса воды, тогда произведение концентраций ионов воды равно:
= 18 г/моль – мольная масса воды, тогда произведение концентраций ионов воды равно:

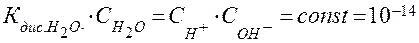 .
.
Это произведение называют ионным произведением воды и обозначают 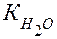 .
.
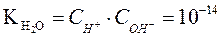 . (29)
. (29)
Следовательно, ионное произведение воды 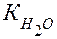 – произведение концентраций ионов Н+ и ОН- - величина постоянная при постоянной температуре не только в чистой воде, но и в любом водном растворе электролита (сильного или слабого), в том числе содержащем кислоты, основания или соли, и при Т= 298К равна 10-14 .
– произведение концентраций ионов Н+ и ОН- - величина постоянная при постоянной температуре не только в чистой воде, но и в любом водном растворе электролита (сильного или слабого), в том числе содержащем кислоты, основания или соли, и при Т= 298К равна 10-14 .
3.2. Среда водных растворов. Водородный показатель pH
Из уравнения (26) следует, что при диссоциации молекул воды ионы H+ и OH- образуются в равных количествах, следовательно, в чистой воде при Т= 298К:
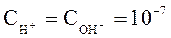 .
.
Растворы, в которых 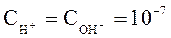 относят к нейтральным.
относят к нейтральным.
Носителями кислотных свойств являются ионы Н+, а носителями основных свойств – ионы ОН-. Поэтому растворы, в которых: 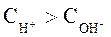 и
и 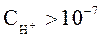 называют кислыми. Растворы, в которых:
называют кислыми. Растворы, в которых: 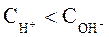 и
и 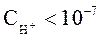 называют щелочными.
называют щелочными.
В практической работе неудобно производить расчеты с концентрациями, выраженными числами с отрицательными показателями степеней. Поэтому принято выражать концентрацию водородных ионов через водородный показатель pH – десятичный логарифм концентрации ионов Н+ , взятый с обратным знаком:
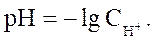 (30)
(30)
Так как в чистой воде концентрации Н+ и ОН- ионов равны, вода является нейтральной средой, которой соответствует рН = 7.
Добавление к воде молекул кислоты увеличивает концентрацию ионов водорода, снижая рН. Следовательно, кислые растворы имеют рН < 7.
Добавление к воде ионов ОН- должно приводить к снижению концентрации ионов водорода, следовательно, все щелочные растворы имеют рН > 7 .
В табл.14 отображены концентрации ионов Н+ и соответствующие значения рН для различных сред водных растворов.
Таблица 14
Концентрации ионов Н+ и значения рН в различных средах
водных растворов.
| Среда | СН+ | рН |
| Кислая | СН+ > СОН- СН+ > 10-7 | < 7 (6,5,4,…0) |
| Нейтральная | СН+ = СОН- = 10-7 | |
| Основная | СН+ < СОН- СН+ < 10-7 | >7 (8,9,10,…14) |
Для кислых, нейтральных и щелочных растворов можно построить единую шкалу рН. Область возможных значений рН: от рН=0 до рН=14.

|




 0 усиление кислотности среды 7 усиление щелочности среды 14
0 усиление кислотности среды 7 усиление щелочности среды 14
|
|
|
Аналогично водородному иногда используют гидроксильный показатель среды - pOH:
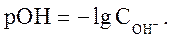 (31)
(31)
Поскольку
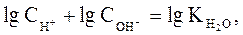 (32)
(32)
в любом водном растворе электролита (кислоты, основания, соли):
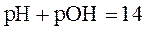 . (33)
. (33)
Дата добавления: 2016-02-24; просмотров: 1537;
