Растворы сильных электролитов
К сильным электролитам относятся такие кислоты, как например, H2SO4, HNO3, HCl и др. галогеноводородные кислоты (кроме HF), HMnO4, H2Cr2O7, HClO3, HClO4; основания - гидроксиды щелочных и щелочноземельных металлов, например, NaOH, RbOH, Ba(OH)2 , и практически все соли.
Согласно теории сильных электролитов Дебая – Хюккеля (1923г.) и Онзагера (1927 г.), молекулы сильных электролитов в водных растворах полностью распадаются на ионы. Их истинная степень диссоциации не зависит от концентрации раствора.
КОН + aq → К+aq + OH- aq - сильное основание (щелочь);
HMnO4 + aq → H+aq + MnO4 2-aq – сильная кислота;
Cr(NO3)3 + aq → Cr3+ aq + 3 NO3 -aq - соль.
Свойства растворов сильных электролитов существенно зависят от степени взаимодействия компонентов раствора друг с другом и с полярными молекулами растворителя.
Для упрощения расчетов, связанных со сложными многочисленными процессами взаимодействий ионов в растворах сильных электролитов, П.Дебаем и Э.Хюккелем было введено понятие ионная атмосфера. Каждый ион в растворе окружен ионами противоположного знака и молекулами воды. Состав ионной атмосферы постоянно меняется в результате теплового движения, поэтому это понятие - статистическое.
На свойства реальных растворов сильных электролитов значительное влияние оказывает электростатическое взаимодействие между ионами. Для учета всех имеющих место в данной системе взаимодействий следует использовать не концентрации С, а «эффективные концентрации», или активности - 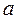
 , а также «кажущуюся степень диссоциации», роль которой играет коэффициент активности
, а также «кажущуюся степень диссоциации», роль которой играет коэффициент активности  . Эти параметры связаны с концентрацией соотношением (11).
. Эти параметры связаны с концентрацией соотношением (11).
Коэффициент активности  зависит от концентраций всех ионов, присутствующих в растворе. Чем меньше концентрация раствора, чем слабее межионное взаимодействие в нем, тем ближе значение g к единице.
зависит от концентраций всех ионов, присутствующих в растворе. Чем меньше концентрация раствора, чем слабее межионное взаимодействие в нем, тем ближе значение g к единице.
В сильно разбавленных растворах можно принять, что
 » 1, а С »
» 1, а С » 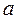 .
.
Для концентрированных растворов необходимо учитывать коэффициент активности  .
.
Его определяют либо экспериментально, либо вычисляют по правилу ионной силы, согласно которому коэффициенты активности ионов одинакового знака в растворах с одинаковой ионной силой J равны по величине.
Ионнаясилараствора определяется как полусумма произведений концентраций всех ионов на квадрат их зарядов :
 J = 0,5 ∑ Сi Zi2, (17)
J = 0,5 ∑ Сi Zi2, (17)
где Сi – молярная концентрация i-го компонента раствора;
Zi - заряд иона i-го компонента раствора.
Теория сильных электролитов приводит к следующему соотношению между средними коэффициентами активности ионов электролита и ионной силой раствора:
ln g± = - А½z+ z-½· J1/2,
где z+ , z- - заряды катионов и анионов; J – ионная сила раствора; А – коэффициент, зависящий от диэлектрической проницаемости и температуры.
Для водных растворов при 250С
lg g± = - 0,509½z+ z-½· J1/2 . (18)
Например, в 0,001 M растворе азотной кислоты ионная сила

 .
.
Соответственно коэффициент активности ионов H+ равен:
lg g± = -0,509ôz+z-ô 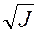 = -0,509•12
= -0,509•12 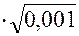 = -0,016;
= -0,016;
g± = g(Н+) = g(NO3-) = 0,96.
Коэффициенты активности ионов Н+ и NO3- - в этом случае равны.
Коэффициенты активности gдля ионов в зависимости от ионной силы или концентрации раствора приведены в справочной литературе.
В табл. 9 приведены приближенные значения  для основных типов ионов в водных растворах при различных значениях ионной силы J.
для основных типов ионов в водных растворах при различных значениях ионной силы J.
Таблица 9
Приближенные значения коэффициентов активности
ионов в водных растворах в зависимости от ионной силы при 250 С
| Ионы | Коэффициент активности g для растворов с ионной силой J | ||||
| 0,001 | 0,005 | 0,01 | 0,05 | 0,1 | |
| Н+ | 0,98 | 0,95 | 0,92 | 0,88 | 0,84 |
| Однозарядные | 0,98 | 0,95 | 0,92 | 0,85 | 0,80 |
| Двухзарядные | 0,77 | 0,65 | 0,58 | 0,40 | 0,30 |
| Трехзарядные | 0,73 | 0,55 | 0,47 | 0,28 | 0,21 |
Задача 2.1.Рассчитайте ионную силу раствора, содержащего 0,01 моль/л ВаCl2 и 0,02 моль/л NаОН. Определите активности ионов Ba2+, Cl-, Na2+ и ОН- в данном растворе.
Решение.
Раствор содержит 2 сильных электролита, полностью распадающихся на ионы согласно следующим уравнениям диссоциации:
ВаCl2 → Ba2+ + 2 Cl-
NaCl →Na+ + ОН- .
Согласно уравнениям диссоциации, концентрации ионов составят:
Ва2+ - 0,01 моль/л; Cl- - в 2 раза больше, т.е. 0,02 моль/л; Na+ - 0,02 моль/л; ОН- - 0,02 моль/л.
Ионная сила данного раствора равна:
J = 0,5 ∑ Сi Zi 2 = 0,5( 0,01∙22 + 0,02∙12 + 0,02∙12 + 0,02∙12 ) = 0,05.
Коэффициенты активности для ионной силы J = 0,05 найдем по правилу ионной силы из табл. 4:
gВа2+ = 0,4; gCl- = 0,85; gNa+ = 0,85; gOH- = 0,85.
Зная концентрации и коэффициенты активности ионов, рассчитываем их активности в данном растворе:
αВа2+=gВа2+CВа2+=0,4∙0,01=0,004моль/л;
αcl- = gCl- CCl- = 0,85 ∙ 0,02 = 0,017 моль/л;
αNa2+ = gNa+ CNа+ = 0,85∙ 0,02 = 0,017 моль/л;
αOH- = gOH- COH- = 0,85∙ 0,02 = 0,017 моль/л.
2.4. Равновесия в растворах слабых электролитов
К слабым электролитам относятся:
- некоторые неорганические и большинство органических кислот HNO2, H2SO3, H2CO3, H2S, HClO, HCN, H2O2, H3BO3, H3PO4, CH3COOH, H2C2O4 и др.;
- многие основания, например, NH4OH, Mg(OH)2, Be(OH)2, Al(OH)3, в том числе гидроксиды переходных d-металлов и f-металлов – Fe(OH)3, Cu(OH)2, La(OH)3 и др.;
- гидроанионы, или кислые анионы, например, HCrO4-; H2PO4-;
- основные катионы, например (CuOH)+, (FeOH)2+; Ti(OH)2+ ;
- комплексные частицы (ионы и молекулы).
Слабые электролиты в растворе толькочастично распадаются на ионы, поэтому в нем присутствуют как растворенные гидратированные молекулы, так и гидратированные ионы, соотношение между которыми определяется степенью диссоциации  . Диссоциация слабых электролитов – процесс обратимый и подчиняется закону действующих масс.
. Диссоциация слабых электролитов – процесс обратимый и подчиняется закону действующих масс.
Количественно диссоциацию слабого бинарного электролита:
KtAn ⇄ Kt+ + An-
характеризуют константой равновесия процесса, названной константой электролитической диссоциации (Кдис.). Согласно закону действующих масс :


(19)
где  - равновесные концентрации соответственно катионов, анионов и молекул слабого электролита.
- равновесные концентрации соответственно катионов, анионов и молекул слабого электролита.
Согласно уравнению диссоциации, равновесные концентрации катионов и анионов  =
=  С, а концентрация молекул электролита, оставшихся в недиссоциированном состоянии равна:
С, а концентрация молекул электролита, оставшихся в недиссоциированном состоянии равна:
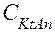 = С -
= С -  ∙ С = С ∙ (1-
∙ С = С ∙ (1-  ). (20)
). (20)
Подставив значения равновесных концентраций (20) в уравнение (19), получим:
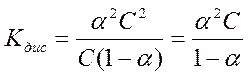 . (21)
. (21)
Уравнение (21) было выведено Оствальдом и получило название закона Оствальда. Если  <<1, то уравнение упрощается:
<<1, то уравнение упрощается:
Кдис.≈  . (22)
. (22)
Кдис - термодинамическая характеристика слабого электролита, зависит только от природы электролита, природы растворителя и температуры электролита, но не зависит от концентрации раствора. Она характеризует способность слабого электролита распадаться на ионы: чем больше значение Кдис , тем полнее электролит диссоциирует. Значения Кдис для многих электролитов приведены в справочниках.
В табл. 10 и 11 приведены значения Кдис. некоторых слабых электролитов.
Таблица 10
Константы диссоциации кислот при 298 К
| Группа в П.С.Э | Формула 
| Кдис.1-ой ступени | Кдис.посл.ступени |
| III A | HBO2 H3BO3 H2B4O7 HAlO2 H3GaO3 HGaO2 HInO2 | 7,5∙10-10 5,8∙10-10 1,0∙10-4 6,0∙10-13 1,6∙10-7 3,8∙10-15 6,7∙10-14 | - 1,6∙10-14 1,0∙10-9 - 2,2∙10-12 - - |
| IV A | CH3COOH H2CO3 HCOOH H2C2O4 HCN H2SiO3 H4SiO4 H2GeO3 H2SnO2 H2SnO3 H2PbO2 | 1,75∙10-5 4,45∙10-7 1,8∙10-14 5,8∙10-2 7,9∙10-10 2,2∙10-10 1,3∙10-10 1,7∙10-9 2,2∙10-15 1,9∙10-9 1,5∙10-10 | - 4,7∙10-11 - 5,4∙10-5 - 1,6∙10-12 2,0∙10-14 2,0∙10-13 1,6∙10-19 3,9∙10-10 2,0∙10-16 |
| IV B | H2ZrO3 H2TiO3 | 1,2∙10-13 - | 1,0∙10-15 2,2∙10-12 |
| V A | HNO2 HNO3 HPO2 H3PO3 H3PO4 H4P2O7 H3AsO3 H3AsO4 HAsO2 H3SbO4 | 6,9∙10-4 >>10-2 1,9∙10-5 1,6∙10-3 7,5∙10-3 1,4∙10-1 5,8∙10-10 6,0∙10-3 6,1∙10-10 4,0∙10-5 | - - - 3,5∙10-13 5,0∙10-13 4,1∙10-10 1,2∙10-15 3,9∙10-12 - 4,2∙10-6 |
| V B | HVO3 H3VO4 H3NbO4 H3TaO4 | 1,2∙10-6 1,8∙10-4 1,2∙10-7 1,0∙10-10 | - 3,8∙10-15 1,0∙10-8 3,9∙10-13 |
| VI A | H2O2 H2S HCN HCNS H2SO3 H2SO4 H2S2O3 H2Se H2SeO3 H2SeO4 H2Te H2TeO3 H2TeO4 | 2,4∙10-12 6,1∙10-8 6,2∙10-10 1,4∙10-1 1,7∙10-2 >10-2 2,5∙10-1 1,3∙10-4 2,4∙10-3 >10-2 1,3∙10-3 2,7∙10-3 2,3∙10-8 | 1,7∙10-25 1,0∙10-14 - - 6,3∙10-8 1,2∙10-2 2,8∙10-2 1,0∙10-11 5,0∙10-9 >10-2 1,0∙10-11 1,9∙10-8 6,5∙10-12 |
| VI B | H2CrO4 H2Cr2O7 HCrO2 H2MoO4 H2WoO4 | ≈1,0 2,3∙10-2 3,1∙10-7 2,9∙10-3 6,3∙10-5 | 3,2∙10-7 1,3∙10-4 - 1,4∙10-4 2,3∙10-6 |
| VII A | HF HCl, HBr, HI HClO HClO2 HClO3, HBrO3 HIO3 HClO4 HBrO4 HIO4 HBrO H5IO6 | 6,6∙10-4 >>10-2 5,8∙10-8 1,1∙10-2 >10-2 >10-2 2,1∙10-9 2,45∙10-2 | - - - - - - 1,0∙10-8 |
| VII B | HMnO4 H2MnO4 | >10-2 ≈10-1 | - 7,1∙10-14 |
Таблица 11
Константы диссоциации оснований при 298 K
| Группа в П.С.Э. | Формулы | Кдис.1-ой ступени | Кдис.посл.ступени |
| I A | LiOH, KOH, NaOH, RbOH, CsOH | >10-2 | - |
| I B | 2 CuOH⇄Cu2O + H2O Cu(OH)2 2 AgOH⇄Ag2O + H2O 2 AuOH⇄Au2O+ H2O 2Au(OH)3⇄Au2O3 + 3H2O | 1,0∙10-4 3,4∙10-7 1,1∙10-4 5,1∙10-5 2,0∙10-12 | - 7,9∙10-14 - - 5,0∙10-16 |
| II A | Be(OH)2 Mg(OH)2 Ca(OH)2,Sr(OH)2,Ba(OH)2, Ra(OH)2 | 8,7∙10-8 - | 5,2∙10-11 2,5∙10-3 |
| II B | Zn(OH)2 Cd(OH)2 Hg2(OH)2 Hg(OH)2⇄HgO + H2O | 4,4∙10-5 5,0∙10-3 7,0∙10-12 5,9∙10-10 | 3,2∙10- 9 1,0∙10-6 2,0∙10-23 5,1∙10-11 |
| III A | Al(OH)3 Ga(OH)3 In(OH)3 TlOH Tl(OH)3 | -1,2∙10-7 1,1∙10-2 >10-2 2,8∙10-5 | 1,4∙10-9 4,0∙10-12 4,5∙10-3 - 1,7∙10-6 |
| III B | Sc(OH)3 Y(OH)3 La(OH)3 Ac(OH)3 Th(OH)4 Ru(OH)4 | 7,6∙10-13 6,1∙10-5 1,6∙10-3 7,1∙10-3 2,0∙10-10 3,2∙10-13 | 7,6∙10-13 4,9∙10-7 5,1∙10-4 4,1∙10-4 1,1∙10-16 1,4∙10-17 |
| IV A | Ge(OH)2 Ge(OH)4 GeO(OH)2 Sn(OH)2 Sn(OH)4 Pb(OH)2 Pb(OH)4 | 4,7∙10-12 1,5∙10-16 2,4∙10-11 1,6∙10-12 3,1∙10-8 9,6∙10-4 1,8∙10-10 | 5,6∙10-13 1,7∙10-17 2,7∙10-13 1,4∙10-14 4,0∙10-10 3,0∙10-8 1,2∙10-13 |
| IV B | Ti(OH)2 Ti(OH)3 Ti(OH)4 TiO(OH)2 Zr(OH)4 ZrO(OH)2 Hf(OH)4 | ||
| V A | NH4OH Bi(OH)3 | 1,8∙10-5 1,0∙10-8 | - 3,1∙10-13 |
| V B | V(OH)2 V(OH)3 VO(OH)2 V(OH)4 VO(OH)3 VO2OH 2 NbO(OH)3 → Nb2O5∙3 H2O 2 TaO(H)3 → Ta2O5∙3 H2O | - - 5,3∙10-8 - 2,6∙10-4 1,1∙10-8 | - - 2,2∙10-10 - 1,6∙10-5 - |
| VI B | Cr(OH)2 Cr(OH)3 Mo(OH)2 Mo(OH)4 → MoO2∙∙ H2O W(OH)2 W(OH)4 → WO2∙∙ H2O | - - - 6,7∙10-12 - - | - 1∙10-10 - 2,1∙10-13 - - |
| VII B | Mn(OH)2 Mn(OH)3 Mn(OH)4 | - - - | 5∙10-4 - - |
| VIII B | Fe(OH)2 Fe(OH)3 Co(OH)2 Ni(OH)2 | - 1,8∙10-11 2,4∙10-4 1,2∙10-4 | 1,4∙10-4 1,3∙10-12 4,0∙10-5 2,5∙10-5 |
Константа диссоциации бинарного электролита связана со степенью диссоциации  соотношением, известным под названием закона разбавления Оствальда:
соотношением, известным под названием закона разбавления Оствальда:
 , (23)
, (23)
где V = 1/C - разведение, или разбавление раствора.
Это уравнение выражает зависимость степени диссоциации от концентрации раствора. Из него следует, что степень диссоциации уменьшается с увеличением концентрации электролита и возрастает с разбавлением и справедливо только для слабых разбавленных электролитов.
В соответствии с принципом Ле-Шателье введение в раствор слабого электролита одноименных ионов уменьшает степень его диссоциации. При уменьшении концентрации одного из ионов диссоциация слабого электролита усиливается. Степень диссоциации и константа диссоциации возрастают при нагревании.
Величина Кдис служит критерием для разделения электролитов на сильные и слабые:
для сильных электролитов Кдис ³ 10-2;
для слабых электролитов Кдис < 10-2.
Если молекула слабого электролита состоит более чем из двух ионов, то электролит диссоциирует ступенчато, а каждая ступень характеризуется своей константой диссоциации, например:
H2S ⇄H+ + HS- Кдис.I = 6.10-8;
HS- ⇄H+ + S2- Kдис II = 1.10-14.
Среди электролитов встречаются такие, которые являются сильными при диссоциации по первой ступени (Кдис.I >10-2), но в последующих стадиях диссоциации проявляют себя как слабые (Кдис. < 10-2), например:
H2Cr2O7 = H+ + HCr2O7- (диссоциация необратима, Кдис.I > 2);
HCr2O7-⇄ H+ + Cr2O72- (диссоциация обратима, Kдис.II = 1,3 . 10-4).
Дата добавления: 2016-02-24; просмотров: 2551;
