Буферные свойства многоосновных кислот
Рассмотрим кратко буферные свойства фосфорной кислоты.
1. График её титрования (рис. 12.2) включает не одну, а три буферные зоны с центрами в точках рКа,1, рКа,2 и рКа,3, довольно далеко отстоящих друг от друга.

 |
а) Вне буферных зон кислота находится, в основном, в одной из своих
четырех возможных форм:
б) В пределах каждой зоны сосуществуют две смежные формы, и соотношение между ними меняется по мере изменения рН.
Это значит, что в каждой такой паре форм одна выступает в качестве сопряженной кислоты, а вторая — в качестве сопряженного основания, поэтому к любой такой паре применимы полученные выше соотношения.
2. Так, например, если мы хотим получить буферный раствор с рН в пределах второй буферной зоны, нам надо взять соли (калиевые или натриевые) двух следующих анионов — 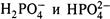 . Первый из этих анионов выступает как кислота:
. Первый из этих анионов выступает как кислота:
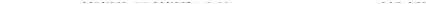 |
поэтому формулу Гендерсона—Хассельбаха в данном случае следует записать так:
Заметим: такой простой подход возможен лишь тогда, когда буферные зоны не перекрываются. В противном случае расчет является более сложным, т.к. при рН, находящемся в пределах области перекрывания, сосуществуют не две, а больше различных форм вещества.
Дата добавления: 2016-03-20; просмотров: 820;
