Гальванические элементы и их электродвижущая сила.
Устройство, в котором энергия химической реакции непосредственно превращается в электрическую энергию, называется гальваническим элементом.
Гальванический элемент состоит из двух соприкасающихся друг с другом растворов электролитов, в которые погружены металлические пластинки — электроды, соединенные между собой внешним проводником. Гальванический элемент, дающий электрический ток, находится в неравновесном состоянии. С уменьшением силы тока разность потенциалов между электродами возрастает. Если сила тока бесконечно мала и система практически находится в состоянии равновесия, элемент этот работает обратимо. Максимальная разность потенциалов, достигаемая при обратимой работе гальванического элемента, называется его электродвижущей силой (эдс).
Элемент называется необратимым, если в системе хотя бы один из процессов является термодинамически необратимым.
В качестве обратимого гальванического элемента рассмотрим элемент Якоби — Даниеля, который состоит из медного и цинкового электродов, погруженных соответственно в растворы CuSO4 и ZnSO4. Схематически этот элемент изображается следующим образом:
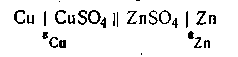
Здесь поверхность раздела двух фаз, между которыми имеет место скачок потенциала, обозначена вертикальной линейкой. Двойная линейка означает, что в месте соприкосновения двух растворов скачок потенциала, обусловленный различной скоростью диффузии ионов (так называемый диффузионный потенциал), снят и его можно не учитывать при вычислении эдс этого элемента. Металл с большей величиной стандартного потенциала (положительный электрод) принято писать слева, а с меньшей величиной (отрицательный электрод)—справа.
Общий вид гальванического элемента Якоби — Даниеля показан на рис. 4.10. В пористом сосуде 1 находится раствор CuSO4, в который погружен медный электрод. Этот сосуд помещен в стеклянную банку 2, содержащую цинковый электрод, находящийся в растворе ZnSO4.
На границе раздела фаз металл — жидкость образуется двойной электрический слой, при этом поверхность металла заряжается отрицательно, прилегающий слой — положительно. При разомкнутой цепи процесс растворения цинка быстро достигает равновесного состояния и приостанавливается. Если цинковый электрод соединить каким-либо проводником с медным электродом, будет наблюдаться совершенно иная картина (рис. 4.11).
|
|
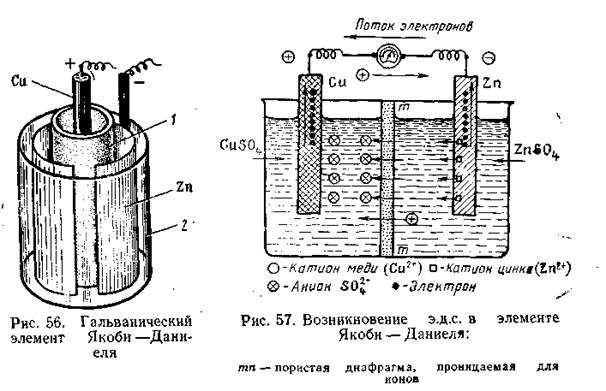
В этом случае избыточные электроны с цинкового электрода потекут на медный, и во внешней цепи возникнет электрический ток, который можно измерить c помощью гальванометра. Электроны, перешедшие на медь, нейтрализуют осадившиеся на ней из раствора CuSO4 ионы Сu2+, превращая их в электронейтральные атомы меди.
Остающиеся свободными сульфат-ионы через пористые стенки сосуда 1 проникают во внешнюю жидкость и, соединяясь с катионами Zn2+ металлического цинка, дают ZnSO4. С другой стороны, катионы цинка в процессе работы гальванического элемента также диффундируют из сосуда 2 через пористую перегородку в сосуд 1, замещая там перешедшие на медную пластинку катионы Сu2+. В результате этого раствор CuSO4 в сосуде 1 постепенно превращается в ZnSO4.
По мере удаления по внешней цепи с цинковой пластинки избытка электронов все новые количества катионов Zn2+ будут переходить в раствор. Гальванический элемент будет работать до тех пор, пока весь цинковый электрод не растворится, т. е. перейдет в состояние катионов Zn2+. После этого электрический ток прекращается.
При работе гальванического элемента происходит одновременный перенос электричества по двум цепям: внешней (поток электронов по проволоке) и внутренней (поток катионов в жидкой фазе элемента). Как видно из рис. 4.11, цинк для внешней цепи играет роль катода (посылает во внешнюю цепь отрицательно заряженные электроны), а для внутренней цепи — анода (посылает во внутреннюю цепь положительно заряженные катионы). Медь для внешней цепи играет роль анода (акцептор электронов), а для внутренней — роль катода (акцептор электронов).
Гальваническая цепь может быть составлена из пар самых разнообразных металлов, из которых каждый погружен в раствор своей соли. Например:
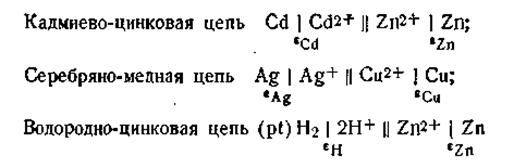
Э.д.с. всех гальванических элементов слагается из величин потенциалов, возникающих на всех границах раздела. Без учета диффузионного потенциала основное уравнение э.д.с. будет иметь вид
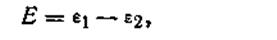
| 4.91 |
где Е — э.д.с. гальванического элемента, ε1 и ε2 — электродные потенциалы.
Э.д.с. любого гальванического элемента равна разности его электродных потенциалов.
Уравнение (4.91) широко используется в электрохимии, и на нем основаны все расчеты, связанные с работой гальванических элементов.
В качестве примера рассмотрим, чему будет равняться э.д.с. только что рассмотренного гальванического элемента Якоби — Даниеля, если концентрации (активности) ионов цинка и меди равны между собой, т. е. аZn2+ = αCu2+ наглядности расчета запишем эту цепь:
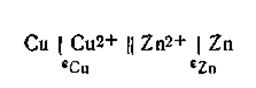
На основании уравнения (4.91) э.д.с. этой цепи будет равна:
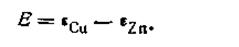
| 4.92 |
Используя уравнение Нернста, можем записать
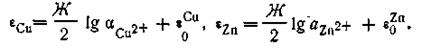
| 4.93 |
С учетом этого уравнение (4.91) может быть представлено так:

| 4.94 |
Поскольку по условию задачи aCu2+ = aZn2+ , уравнение (4.94) еще более упростится:
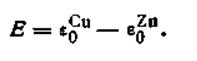
| 4.95 |
Э.д.с. гальванического элемента, составленного из двух разных электродов, но с одинаковой концентрацией (активностью) их солей, равна разности стандартных потенциалов этих элементов.
Подставляя численные значения 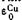 и
и 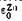 , получим E=+0,34—(—0,76)=1,1 В. Опыт показывает, что эта величина очень хорошо совпадает с экспериментально найденной э.д.с. медно - цинкового элемента.
, получим E=+0,34—(—0,76)=1,1 В. Опыт показывает, что эта величина очень хорошо совпадает с экспериментально найденной э.д.с. медно - цинкового элемента.
Дата добавления: 2016-02-20; просмотров: 3539;
