Концентрационные цепи.
Известны гальванические элементы, в которых электрическая энергия образуется не за счет химической реакции, а за счет разницы концентраций растворов, в которые опущены электроды из одного и того же металла. Такие гальванические элементы называются концентрационными (рис. 4.12). В качестве примера можно назвать цепь, составленную из двух цинковых электродов, погруженных в растворы ZnSO4 различной концентрации:
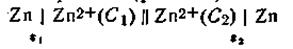
В этой схеме С1 и С2— концентрации электролитов, причем C1>C2 Поскольку металл обоих электродов один и тот же, стандартные потенциалы их (εoZn ) также одинаковы. Однако из-за различия концентрации катионов металла равновесие
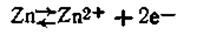
в растворе в обоих полуэлементах неодинаково. В полуэлементе с менее концентрированным раствором (С2) равновесие несколько сдвинуто вправо, т. е.
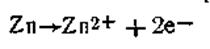
В этом случае цинк посылает в раствор больше катионов, что приводит к возникновению на электроде некоторого избытка электронов. По внешней цепи они перемещаются ко второму электроду, погруженному в более концентрированный раствор сульфата цинка ZnSO4.
Таким образом, электрод, погруженный в раствор большей концентрации (C1), зарядится положительно, а электрод, погруженный в раствор меньшей концентрации, зарядится отрицательно.
В процессе работы гальванического элемента концентрация С1 постепенно уменьшается, концентрация С2 увеличивается. Элемент работает до тех пор, пока сравняются концентрации у анода и катода.
Вычисление э.д.с. концентрационных элементов рассмотрим на примере цинкового концентрационного элемента.
Допустим, что концентрация C1 = l моль/л, а С2 = 0,01 моль/л. Коэффициенты активности Zn2+ в растворах этих концентраций соответственно равны: f1 = 0,061, а f2 = 0,53. Для вычисления э.д.с. цепи воспользуемся уравнением (4.91). На основании уравнения Нернста можем написать

| 4.98 |
где a1 и а2 — активности катионов Zn2+ в первом и во втором полуэлементах. Подставляя эти значения ε1 и ε2 в уравнение (4.91), получим

| 4.99 |
Учитывая, что
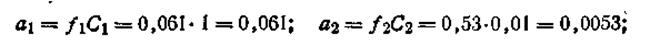
получим
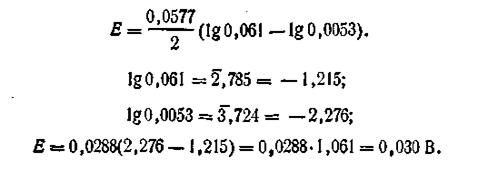
| 4.100 |
Таким образом, э.д.с. цинковой концентрационной цепи равна 0,030 В. Общее уравнение для вычисления э.д.с. подобных цепей имеет вид
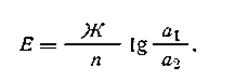
| 4.101 |
 Из уравнения (4.100) видно, что концентрацию ионов в данном рас- творе можно легко вычислить, если составить цепь, один из электродов которой опущен в исследуемый раствор, а другой— в раствор с известной активностью тех же ионов. Для этой цели необходимо только измерить э.д.с. составленной цепи, что может быть легко сделано с помощью соответствующей установки. Концентрационные цепи широко используются в практике для определения рН растворов, произведения растворимости труднорастворимых соединений, а также для определения валентности ионов и констант нестойкости в случае комплексообразования.
Из уравнения (4.100) видно, что концентрацию ионов в данном рас- творе можно легко вычислить, если составить цепь, один из электродов которой опущен в исследуемый раствор, а другой— в раствор с известной активностью тех же ионов. Для этой цели необходимо только измерить э.д.с. составленной цепи, что может быть легко сделано с помощью соответствующей установки. Концентрационные цепи широко используются в практике для определения рН растворов, произведения растворимости труднорастворимых соединений, а также для определения валентности ионов и констант нестойкости в случае комплексообразования.
Дата добавления: 2016-02-20; просмотров: 1351;
