Электрометрический (потенциометрический) метод определения pH.
Концентрацию водородных ионов в растворах наиболее точно можно определять электрометрическим методом. Для этой цели нужно составить гальваническую цепь так, чтобы потенциал одного из электродов находился в зависимости от концентрации ионов Н+. Такими электродами являются рассмотренные ранее водородный, хингидронный, сурьмяный и стеклянный электроды.
Рассмотрим наиболее употребительные в практике определения pH гальванические цепи.
Водородная цепь. В основу этого метода определения положен принцип измерения э.д.с. в концентрационном элементе, составленном из двух водородных электродов, один из которых погружен в исследуемый раствор, другой, служащий электродом сравнения, – в буферный раствор, pH которого точно известен.. Схема водородно - водородной цепи
(Pt)H2 | H+(ст) | KCl | H+ | H2(Pt),
εн(ст) εн
ее э.д.с
| Е = εн(ст) – ε н | 4.122 |
В этой цепи более положительный потенциал у водородного электрода, имеющего точно известную концентрацию водородных ионов.
Исходя из уравнения электродного потенциала водородного электрода, можем написать
| εн(ст) = Ж lg[H+]ст и εн = Ж lg[H+]. | 4.123 |
εн(ст) = Ж lg[H+]ст и εн = Ж lg[H+].
Подставляя эти значения в уравнение (4.122), получим
Е = Ж lg[H+]ст –– Ж lg[H+] или Е = Ж(pH –– pH ст),
откуда легко найти pH исследуемого раствора:
| pH = Е/Ж + pH ст или pH = Е/0,0577 + pH ст, | 4.124 |
где Е – э.д.с. водородно – водородной цепи; pH ст – pH буферного стандартного раствора.
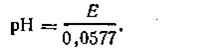
| 4.125 |
 Если в качестве электрода сравнения взять нормальный водородный электрод, у которого [H+]ст = 1 моль/л, уравнение (4.124) примет еще более простой вид: 4.125.
Если в качестве электрода сравнения взять нормальный водородный электрод, у которого [H+]ст = 1 моль/л, уравнение (4.124) примет еще более простой вид: 4.125.
Каломельно-водородная цепь. В этой цепи водородный электрод является индикатор-

4.125
ным электродом, каломельный — электродом сравнения (рис. 4.18). Испытуемый раствор, находящийся в стаканчике водородного электрода 3, соединен с каломельным электродом
через солевой мостик 2 с насыщенным раствором КСl. Схематически цепь изображается так:
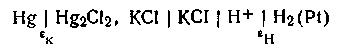
В этой цепи положительным является каломельный электрод 1; так как концентрация водородных ионов в исследуемом растворе меньше единицы, потенциал водородного электрода меньше нуля, т. е. имеет отрицательный знак. Таким образом, э.д.с. каломельно-водородной цепи
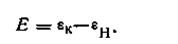
| 4.126 |
Если потенциал каломельного электрода известен, а потенциал водородного электрода εн=Жlg[Н+], нетрудно найти э.д.с. каломельно – водородной цепи: Е = εк— Жlg[H+], или —lg[H+] = (Е—εк) /Ж, откуда
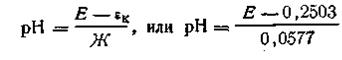
| 4.127 |
 где 0,2503 — потенциал каломельного (насыщенного) электрода при 291 К.
где 0,2503 — потенциал каломельного (насыщенного) электрода при 291 К.
|
с каломельным электродом (рис. 4.19). Схематически эта цепь изображается следующим образом:
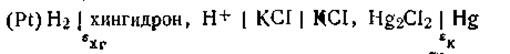
В ней положительным является хингидронный электрод, а отрицательным — каломельный. Э.д.с. цепи
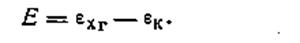
| 4.128 |
Потенциал каломельного электрода известен, потенциал хингидронного электрода
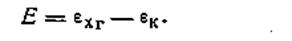
| 4.129 |
Подставляя значения потенциалов в уравнение (4.129), получим

| 4.130 |
Подставляя вместо ε0хг, εк и Ж их численные значения, получим

| 4.131 |
Двойная хингидронная цепь. Для измерения рН в практике часто применяется двойная хингидронная цепь, т. е. цепь, составленная из двух хингидронных электродов. Эта цепь составляется следующим образом. В один стакан наливают раствор, рН которого известен. Обычно в качестве стандартного раствора берут буферную смесь, состоящую из одного объема 0,1 н. НСl и 9 объемов 0,1 н. KCl Такой раствор, именуемый раствором Вейбеля, имеет рН 2,04. В другой стакан наливают исследуемый раствор, рН которого необходимо определить. В оба стакана добавляют в избытке хингидрон и вставляют платиновые электроды. В целях устранения диффузионного потенциала цепь соединяется через агаровый сифон с насыщенным раствором КСl Схематически двойную хингидронную цепь можно записать так:
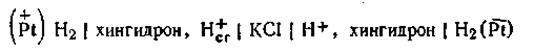
Знаки электродов в данной схеме указаны для случая, если [Н+]cт больше [Н+] исследуемого раствора. Если это условие не выполняется, знаки заряда электродов в цепи будут обратными. Э.д.с. двойной хингидронной цепи
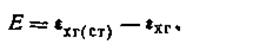
| 4.132 |
Подставляя в это уравнение значения потенциалов хингидронных электродов, получим
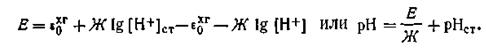
| 4.133 |
Учитывая, что в качестве стандартного раствора берется раствор Вейбеля, уравнение (4.133) примет следующий вид:
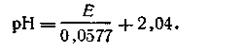
| 4.134 |
Каломельно-стеклянная цепь. В этой цепи стеклянный электрод с водородной функцией является индикаторным электродом, а каломельный— электродом сравнения. На рис. 4.20 показана простейшая схема элемента со стеклянным электродом, которая условно записывается так:
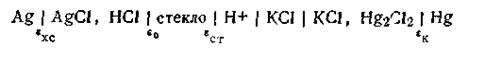
 Прежде чем приступить к измерению рН исследуемого раствора, проводят калибрование стеклянного электрода по серии буферных растворов с известным значением рН и по полученным данным строят калибровочный график. Далее уже по значению э.д.с. с помощью графика определяют рН исследуемого раствора.
Прежде чем приступить к измерению рН исследуемого раствора, проводят калибрование стеклянного электрода по серии буферных растворов с известным значением рН и по полученным данным строят калибровочный график. Далее уже по значению э.д.с. с помощью графика определяют рН исследуемого раствора.
Работая со стеклянным электродом, необходимо иметь в виду, что из-за большого внутреннего сопротивления стеклянного электрода сила тока, протекающего через элемент со стеклянным электродом, очень мала. Так как обычные гальванометры (стрелочный или зеркальный) не могут быть использованы в компенсационной установке в качестве нульинструмента, для измерения э.д.с. элементов с большим внутренним сопротивлением применяют такие потенциометры, которые практически не потребляют тока исследуемого элемента.
Наша промышленность выпускает большое число различных ламповых рН-метров. В этих приборах шкалы измерительного устройства градуированы в единицах рН, так что необходимость строить градуировочный график отпадает. Наиболее широко распространенными являются приборы марок ЛП-58, ЛПУ-0,01, ППП-58 и др.
Дата добавления: 2016-02-20; просмотров: 6323;
