Криоскопическим методом.
Цель работы.
1. Освоить методику криоскопического метода исследования.
2. Определить концентрацию, молекулярную массу и осмотическое давление исследуемого раствора (см. с. 280-282 ).
3. Рассчитать относительную ошибку работы.
ЗАДАНИЕ 2. Определение количества растворенных веществ и величины осмотического давления почвенных или растительных вытяжек.
Цель работы.
1. Освоить методику криоскопического метода исследования.
2. Определить общее содержание растворенных веществ в вытяжках исследуемых почв и растений (см. с. 280-282 ).
3. Сделать выводы.
ЗАДАНИЕ 3. Определение изотонического коэффициента, кажущейся степени электролитической диссоциации, осмотического давления и ионной силы растворов сильных электролитов.
Цель работы.
1. Освоить методику криоскопического метода исследования.
2. Определить изотонический коэффициент (см. с. 280-282).
Рассчитать осмотическое давление, кажущуюся степень диссоциации и ионную силу раствора.
ЗАДАНИЕ 4. Определение степени и константы электролитической диссоциации методом электропроводности.
Цель работы.
1. Освоить метод кондуктометрии.
2. Определить степень и константу электролитической диссоциации растворов NH4OH или CH3COOH (см. с. 282-283 ).
3. Рассчитать относительную ошибку работы.
4. Изобразить графически χ =¦(С), α = ¦(С) и λv = ¦(V).
5. Сделать выводы.
ЗАДАНИЕ 5. Определение содержания различных ионов в растворах методом кондуктометрического титрования.
Цель работы.
1.Освоить методику кондуктометрического титрования.
2.Определить содержание заданных ионов (Н+, ОН-, Cl-, SO42- и др.) в растворах (см. с. 283-284).
3.Рассчитать относительную ошибку работы.
ЗАДАНИЕ 6. Определение рН и буферной емкости почвенных
растворов потенциометрическим методом.
Цель работы.
1. Освоить колориметрический и потенциометрический методом определения рН (см. с.285-286 ).
2. Определить величины рН и буферной емкости почвенных вытяжек образцов почв различных горизонтов.
3. Сопоставить данные рН и буферных емкостей и сделать выводы.
ЗАДАНИЕ 7. Приготовление буферных растворов и изучение
их свойств.
Цель работы.
1.Освоить методику потенциометрического метода.
2.Приготовить буферную смесь и изучить ее свойства (см.с.286-
288).
3. Рассчитать буферную емкость и сделать выводы.
ЗАДАНИЕ 8.Приготовление буферных растворов и расчет активности водородных ионов.
Цель работы:
1. Освоить методику потенциометрического метода.
2. Составить буферные системы согласно заданию и измерить величины их рН (см. с 288-289).
3. Рассчитать активность водородных ионов в растворах.
4. Определить ошибку работы и сделать выводы.
МЕТОДИКА ПРОВЕДЕНИЯ РАБОТ
ЗАДАНИЕ 1 –3. Методика измерения криоскопическим методом
1. Подготовка к работе. Собирают криоскоп, во внутреннюю пробирку наливают 50 см3 дистиллированной воды, опускают термометр и мешалку. Во внешний сосуд помещают охлажденную смесь, состоящую из снега или измельченного льда и соли, реакция растворения которой сопровождается поглощением тепла (например, NaCl) в соотношении с 1 : 3.
2. Измерение температуры замерзания растворителя (Тз).
При помощи специального проволочного смесителя осторожно перемешивают растворитель (Н2О) в пробирке до момента появления кристаллов, фиксируют и записывают в табл. 4.13 значения Тз. При необходимости большей точности измерение температуры проводят с помощью термометра Бекмана. Пробирку вынимают из криоскопа, нагревают рукой или струей воды до исчезновения кристаллов и опыт по определению температуры замерзания повторяют, находя среднее значение Тз.
Таблица 4.13 Результаты криоскопических исследований
Исследуемое вещество (хим. формула) ___, m = 0,5 -1,0 г. Растворитель – вода, W = 50 г
| Измерение Тз | 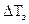
| Росм, н/м2 | М | Сm, моль/кг | I | α | μ | |||
| среднее | ||||||||||
| Растворитель | —- | —— | — | —— | — | — | — | |||
| Раствор |
3. Измерение температуры замерзания раствора (  ).
).
В пробирку, содержащую 50 см3 воды добавляют точно взвешенную навеску (0,5-1 г) исследуемого вещества, помещают ее в охлаждающую смесь и равномерно перемешивают раствор, измеряют его температуру замерзания. Опыт повторяют, определяют среднее значение Т, данные записывают в табл. 4.13.
4. Вычисления.Понижение температуры замерзания раствора (LТз) находят как разность между температурами замерзания раствора(Тз,р-ра) и растворителя(Тз,о)
LТз = Тз(,о)- Тз(,р-ра.) , (4.152)
Зная LТЗ можно рассчитать:
для неэлектролитов:
а) - молярную концентрацию, Сm
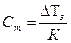 ; (4.153)
; (4.153)
б) - осмотическое давление, Росм
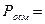
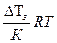 ; (4.154)
; (4.154)
где: Росм – осмотическое давление; R – универсальная газовая постоянная (см. приложение); Т - температура окружающей среды, К;
в) - молекулярную массу растворенного вещества, М
 ; (4.155)
; (4.155)
для электролитов:
а )- изотонический коэффициент (i) :
i =  , (4.156)
, (4.156)
где 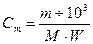 ;
;
б) - кажущуюся степень диссоциации электролита (a) :
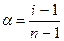 (4.157)
(4.157)
где: n – количество ионов, на которые диссоциирует данный электролит;
- в) - ионную силу раствора (m,) - см. ур-ние 4.23.
Дата добавления: 2016-02-20; просмотров: 1198;
