Окислительно-восстановительные реакции и потенциалы
В почвах.
Окислительно-восстановительные процессы играют важную роль в почвообразовании, на что впервые указал В. Р. Вильямс. В этой связи почву можно рассматривать как сложную окислительно-восстановительную систему. Нормальный рост и развитие растений возможны только при определенном окислительно-восстановительном состоянии почвы.
Характерной особенностью почвенных условий является необратимость большинства реакций окисления и восстановления, протекающих в почве. Обратимые реакции, которые полностью подчиняются всем рассмотренным выше теоретическим положениям, свойственны только некоторым окислительно-восстановительным системам — окислению и восстановлению железа (Fe3+↔Fe2+), марганца (Мп4+↔Мп2+), азота (N5+↔N3+) и др. С другой стороны, в почве протекает большое число окислительно-восстановительных реакций биохимической природы.
Важнейшим и наиболее сильным действующим окислителем в почве является молекулярный кислород, содержащийся в почве и почвенном растворе. Поэтому направление и развитие окислительно-восстановительных процессов в почве тесно связано с условиями се аэрации и, следовательно, зависит от всех свойств почвы, влияющих на ее газообмен — структуры, плотности, механического состава, а также влажности. Ухудшение аэрации в результате повышения влажности почвы, ее уплотнение, образование так называемой корки на ее поверхности и целый ряд других причин приводят к снижению окислительно-восстановительного потенциала почвы.
Опыт показывает, что в нормально аэрируемых почвах ОВ-потенциал варьирует в пределах 300—650 мВ. Заболачивание и оглеение снижают его до 200 мВ и ниже. Бурное развитие биологических процессов также способствует снижению ОВ-потенциала почвы вследствие потребления кислорода микроорганизмами и корнями растений.
От окислительно-восстановительных условий в почве (т. е. от величины ОВ-потенциала) зависит подвижность, а следовательно, и доступность для растений таких элементов, как железо, марганец, азот и др. Например, увеличение содержания в почвенном растворе веществ с высоким ОВ-потенциалом отрицательно сказывается на процессах фиксации атмосферного азота микроорганизмами (так называемыми азотобактерами, в частности azotobacter chlorococcum). Процессы нитрификации, денитрификации и аммонификации также идут при определенных окислительно-восстановительных условиях, т. е. в определенном интервале значений ОВ-потенциалов.
Превращение соединений серы (аналогично остальным микробиологическим процессам) находится в зависимости от ОВ-состояния в почве. Так, сульфиды могут окисляться серобактериями, а сульфаты восстанавливаться сульфатредуцирующими бактериями по следующей схеме: SO42-↔S4O62-↔S2O32-↔S↔SH-. При разложении органических веществ в условиях высоких значений ОВ-потенциала в почве образуются преимущественно сульфаты, а при его низких значениях, т. е. в анаэробных условиях,— сульфиды.
В настоящее время накоплены данные о содержании в различных почвах соединений железа, марганца и нитратов, что позволяет сделать определенные обобщения и указать примерные границы окислительно-восстановительных условий, т. е. интервал оптимальных значений ОВ-потенциала и рН нормального усвоения высшими растениями этих элементов. Опыт показывает, что для различных почв по-разному изменяется ОВ-потенциал в зависимости от изменения внешних условий. Для одних почв изменение значений εh происходит резко, для других—не столь резко, поскольку окислительно-восстановительные системы почв обладают различной загруженностью (емкостью) и податливостью к изменениям. Рассмотрим это положение более подробно.
Окислительно-восстановительный потенциал среды определяется в общем виде уравнением
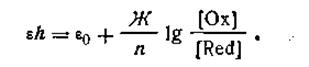
 В почве отношение концентраций окислителя и восстановителя редко бывает равно единице, а концентрация компонентов ОВ-системы в целом низкая. Этим и объясняется чрезвычайная податливость почвы к изменению и снижению величины ОВ-потенциала при увлажнении.
В почве отношение концентраций окислителя и восстановителя редко бывает равно единице, а концентрация компонентов ОВ-системы в целом низкая. Этим и объясняется чрезвычайная податливость почвы к изменению и снижению величины ОВ-потенциала при увлажнении.
| 4.151 |
Повышение содержания органического вещества в почве повышает ее буферность (загруженность), поэтому все мероприятия, направленные на повышение содержания гумуса в почве, положительно сказываются на ее ОВ-состоянии.
Поскольку в почве всегда имеется большое число окислительно-восстановительных систем, главной или, как ее еще называют, потенциалопределяющей системой всегда будет та, которая имеет максимальную загруженность по сравнению со всеми остальными. Иными словами, ОВ-потенциал любой среды, в том числе и почвы, определяется максимально загруженной системой, которая потому и называется потенциалопределяющей. В зависимости от конкретных условий эта система может быть химической (реакции окисления — восстановления) и биологической (деятельность микроорганизмов).
Окислительно-восстановительный потенциал εh, а также загруженность буферной системы являются важными характеристиками почвы с точки зрения ее плодородия.
 § 74. Потенциометрическое титрование.
§ 74. Потенциометрическое титрование.
Потенциометрическое титрование, как и определение активных концентраций ионов, является важнейшим практическим приложением измерений э.д.с. При потенциометрическом титровании эквивалентная точка определяется не по изменению цвета индикатора, как при обычном объемном методе титрования, а по изменению скачка потенциала индикаторного электрода. Особо удобно потенциометрическое титрование, например, при титровании окрашенных или мутных растворов, когда нельзя использовать обычные индикаторы. Кроме прямого аналитического назначения, потенциометрическое титрование часто используют для определения свойств титруемых соединений — константы диссоциации слабых электролитов, количества активных групп и др.
Рассмотрим процесс титрования какой-либо сильной кислоты щелочью с использованием в качестве индикатора водородного электрода.

|
 В начале титрования концентрация водородных ионов (а следовательно, рН среды) уменьшается постепенно. Однако вблизи эквивалентной точки это уменьшение становится значительным даже от прибавления весьма малых количеств щелочи. После прохождения эквивалентной точки изменение рН раствора вновь становится небольшим. Соотношения между изменением концентрации ионов Н+ и потенциалом водородного электрода (Е) в случае титрования 0,1 н. раствора соляной кислоты 0,1 н. раствором едкой щелочи показаны в табл. 4.12.
В начале титрования концентрация водородных ионов (а следовательно, рН среды) уменьшается постепенно. Однако вблизи эквивалентной точки это уменьшение становится значительным даже от прибавления весьма малых количеств щелочи. После прохождения эквивалентной точки изменение рН раствора вновь становится небольшим. Соотношения между изменением концентрации ионов Н+ и потенциалом водородного электрода (Е) в случае титрования 0,1 н. раствора соляной кислоты 0,1 н. раствором едкой щелочи показаны в табл. 4.12.
Как видно из табл. 4.12, на нейтрализацию последней части кислоты (0,1%) при добавлении такого же избытка едкого натра (0,1%) приходится изменение концентрации водородных ионов от 10-4 до 10-10, что соответствует изменению рН на шесть единиц. Именно по этой причине кривая титрования сильной кислоты сильной щелочью, изображенная на рис. 4.23, около самой точки эквивалентности практически перпендикулярна оси абсцисс. Это резкое изменение рН около точки эквивалентности называется скачком титрования (нейтрализации) . Как видно из рис 4.23, точка А, соответствующая моменту нейтрализации раствора (рН 7,0), находится как раз посередине скачка нейтрализации, при этом потенциал водородного электрода Е = 0,058 lg 10-7 = —0,058·7= — 0,406 В.
Дата добавления: 2016-02-20; просмотров: 1201;
