Окислительно-восстановительные потенциалы.
 Окислительно-восстановительными называются такие реакции, при которых происходит взаимное окисление и восстановление различных веществ. Окисление вещества сопряжено с удалением электронов из составляющих его частиц, а восстановление — с присоединением их к частицам. Иными словами, окислительно-восстановительные реакции происходят с передачей электронов от восстановителя к окислителю.
Окислительно-восстановительными называются такие реакции, при которых происходит взаимное окисление и восстановление различных веществ. Окисление вещества сопряжено с удалением электронов из составляющих его частиц, а восстановление — с присоединением их к частицам. Иными словами, окислительно-восстановительные реакции происходят с передачей электронов от восстановителя к окислителю.
Примером окислительно-восстановительной реакции может служить восстановление хлорида железа (III) хлоридом олова в растворе
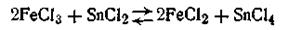
или в ионной форме
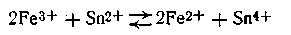
В этой реакции электроны от ионов олова (II) переходят к ионам железа (III).
Ионная окислительно-восстановительная реакция может быть осуществлена в гальваническом элементе с двумя окислительно-восстановительными электродами. Напомним, это окислительно-восстановительный электрод представляет собой пластинку инертного металла (платины, золота), опущенную в раствор, содержащий ионы различной зарядности.
Если платиновую пластинку опустить, например, в раствор хлорида железа (III), а вторую такую же — в раствор соли олова (II), разделить растворы электролитов пористой перегородкой (или соединить их с помощью агарового сифона), а затем соединить платиновые пластинки между собой с помощью металлического проводника, в цепи возникает электрический ток. Обнаружить его можно с помощью гальванометра, включенного в цепь этого элемента (рис. 4.21). Электрическая энергия в данном элементе возникает за счет окисления ионов олова:
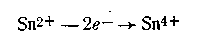
и восстановления ионов железа:
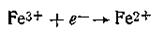
Ионы олова (II), отдавая электроны металлу, сообщают электроду положительный заряд. В то же время ионы железа (III) стремятся присоединить электроны, принадлежащие металлу, сообщая электроду положительный заряд. В данном случае инертный металл (платина) играет роль передатчика электронов и не претерпевает в процессе реакции никаких химических превращений. В этом и заключается отличие окислительно-восстановительных элементов от других гальванических элементов, в которых хотя и происходят реакции окисления — восстановления, электроды в процессе реакций химически изменяются (например, растворение цинка в медно-цинковом элементе Якоби — Даниеля).
К окислительно-восстановительным гальваническим элементам относятся такие элементы, которые состоят из двух окислительно-восстановительных электродов. Причем каждый из электродов представляет собой пластинку из благородного металла, опущенную в раствор разнозаряженных ионов. Потенциал, возникающий на границе соприкосновения пластинки с раствором, называется окислительно-восстановительным потенциалом.
Рассмотрим теперь, как зависят величина и знак этого потенциала от соотношения концентраций (активностей) ионов разной зарядности в растворе. Допустим, что мы имеем водный раствор солей железа (III) и (II), в который погружена платиновая пластинка. Поскольку эти ионы оказываются разнозарядными, между ними должно существовать равновесие:
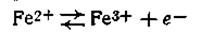
Как и во всех нейтральных реакциях, здесь можно определить константу равновесия:
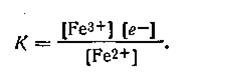
| 4.135 |
Введение в данную систему дополнительного количества электронов повлечет за собой уменьшение концентрации окисленной и повышение содержания восстановленной форм. Уменьшение же концентрации электронов будет способствовать увеличению концентрации окисленной и понижению восстановленной форм.
Таким образом, характер и направление процесса в окислительно-восстановительной реакции зависит от того, насколько легко восстановитель отдает свои электроны и насколько прочно эти электроны связывает окислитель. Иными словами, окислительные свойства той или иной ОВ-системы определяются прочностью связи электронов с окисленной и восстановленной формами ее компонентов. Это позволяет выражать окислительно-восстановительные свойства любых систем при помощи так называемого ОВ-потенциала, возникающего на поверхности платиновой пластинки при погружении ее в эти системы. Величина потенциала, обозначаемого eh, зависит от того, насколько легко система отдает свои электроны. Можно считать, что потенциал окислительно-восстановительного электрода
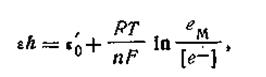
| 4.136 |
где [еМ] — концентрация электронов (или упругость электронного газа) в металле; [е-] — та же величина для окислительно-восстановительной системы; n — разность между зарядностями ионов (для рассматриваемой системы Fe3+↔Fe2+ n=l).
Из уравнения (4.135) определим величину [е-]:
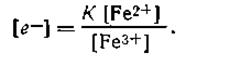
| 4.137 |
Подставляя это значение в уравнение (4.137), получим
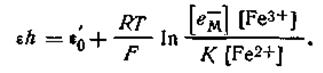
| 4.138 |
Вследствие большой емкости металлического электрода величину [ем] можно считать постоянной. Объединяя величины [ем], Е0 и К в одну постоянную е0, получим

| 4.139 |
Таким образом, для любой окислительно-восстановительной реакции типа

где Ох — окислитель; Red — восстановитель; е- — электрон, потенциал окислительно-восстановительного электрода выразится уравнением
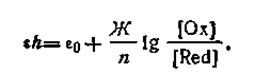
| 4.140 |
Более высокий потенциал показывает, что реакция (а) сдвинута вправо. При низком потенциале реакция будет сдвинута влево.
Все это приводит к выводу о том, что величина окислительно-восстановительного потенциала служит мерой интенсивности процессов окисления — восстановления, протекающих в данной системе, и зависит от соотношения в ней концентраций (активностей) окисленной и восстановленной форм ионов, образующих данную систему. Величина ε0 в уравнениях (4.139) и (4.140) называется нормальным потенциалом окислительно-восстановительного электрода. Она определяется по отношению к нормальному водородному электроду и равна потенциалу данного окислительно-восстановительного электрода при условии, что активные концентрации ионов обеих зарядностей равны между собой, т. е. [Ox]=[Red]. В качестве иллюстрации в табл. 4.10 приведены некоторые величины нормальных потенциалов для различных окислительно-восстановительных электродов.
При сочетании какого-либо электрода в гальваническом элементе с одним из нижестоящих в этой таблице электродов, имеющим более положительный потенциал, протекает реакция окисления. И наоборот, реакция восстановления будет протекать при сочетании электрода с вышестоящими более отрицательными электродами.
 Нормальные окислительно-восстановительные потенциалы характеризуют окислительно-восстановительную способность веществ по отношению друг к другу, так как они являются мерой изменения изобарного потенциала ∆G (максимальной работы) при окислительно-восстановительном взаимодействии веществ. Нормальный потенциал любой окислительно-восстановительной системы может быть вычислен по формуле
Нормальные окислительно-восстановительные потенциалы характеризуют окислительно-восстановительную способность веществ по отношению друг к другу, так как они являются мерой изменения изобарного потенциала ∆G (максимальной работы) при окислительно-восстановительном взаимодействии веществ. Нормальный потенциал любой окислительно-восстановительной системы может быть вычислен по формуле
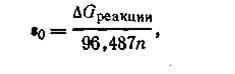
| 4.141 |
где ∆G — стандартное изменение свободной энергии, отнесенное к 1 моль; n — число валентных электронов, участвующих в реакции; 96,487 — число Фарадея, кДж/В, отнесенное к 1 моль.
Так, для рассмотренной выше системы (а), потенциал которой выражается уравнением (4.142), можно записать
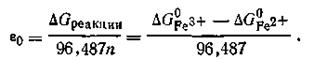
| 4.142 |
Подставляя в это уравнение численные значения ∆G0 Fe3+ и ∆G0 Fe2+ из специально составленных таблиц, получим
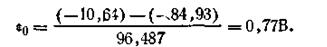
| 4.143 |
С учетом этого уравнение окислительно-восстановительного потенциала для системы Fe3+—Fe2+ примет вид
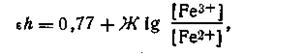
| 4.144 |
где [Fe3+] и [Fe2+] — активные концентрации данных ионов в растворе.
Все рассматриваемые уравнения, выражающие величину ОВ-потенциала, были выведены для простейших реакций, когда кроме окислителя и восстановителя в реакции не участвуют другие компоненты. В наиболее общем случае под знаком логарифма должны находиться равновесные концентрации (активности) всех участвующих в реакции соединений. Иными словами, в уравнении (4.144) под окисленной формой следует понимать все ионы раствора в правой стороне уравнения реакции (а), а под восстановленной — все ионы раствора слева от знака равенства. Так, для какой-либо реакции типа
Аm + В + Nv ↔An + D + Сλ + (n - m) е-
окислительно-восстановительный потенциал будет равен:
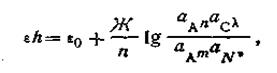
| 4.145 |
где Аn и Ат — ионы соответственно окисленной и восстановленной форм, В и D —твердые фазы; Nv и Сλ — ионы раствора, не участвующие в окислительно-восстановительных реакциях.
Часто, особенно в реакциях органических соединений, окисление и восстановление происходят с участием водородных ионов. Роль их во всех окислительно-восстановительных процессах следует оценивать исходя из конкретных условий реакции. При этом возможны три случая: 1) водородные ионы вовсе не участвуют в ОВ-реакции; 2) водородные ионы непосредственно участвуют в окислительных процессах; 3) косвенное влияние водородных ионов.
Первый случай. Ионы водорода не принимают участия в окислительно-восстановительных реакциях простых ионов металлов и ряда анионов. Например:
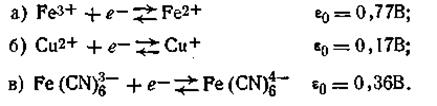
Во всех этих и подобных реакциях εh не зависит от рН, если оба компонента смеси одинаково хорошо растворимы.
Второй случай. Реакции многих органических соединений, а также некоторых кислородсодержащих анионов часто сопровождаются образованием воды или слабых кислот. В этих реакциях непосредственное участие принимают ионы водорода, потому и величина εh таких окислительно-восстановительных систем зависит от рН. Примером подобных реакций может служить рассмотренный нами ранее хингидронный электрод, а также реакции типа:
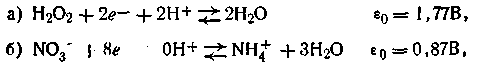
или в общей форме
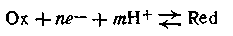
Уравнение для εh таких систем с участием т ионов водорода записывают так:
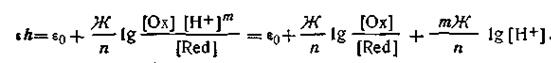
| 4.146 |
Из этого уравнения следует, что по мере подкисления раствора εh систем увеличивается. Величина сдвига ОВ-потенциала в общем случае зависит от числа электронов и числа ионов водорода, участвующих в реакции, и определяется коэффициентом уравнения (4.146):
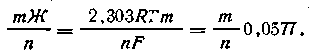
| 4.147 |
Третий случай. В реакциях этого типа водородные ионы оказывают на εh косвенное влияние в результате изменения растворимости компонентов системы при подкислении или подщелачивании раствора. В качестве примера можно рассмотреть равновесие в системе Fe2+— Fe3+. Допустим, что одновременно имеется 0,1 н. раствор ионов Fe2+ и Fe3+.Величина εh определяется уравнением (при условии, что коэффициенты активности близки к единице)
εh = ε0 + 0,0577 lg [Fe3+] / [Fe2+] .
При рН, например, равном 6,0, количество ионов железа в растворе можно вычислить из произведений растворимости:

| 4.148 |
|

В этих уравнениях значения [ОН-] найдены из уравнения ионного произведения воды. Для рН 6,0 [ОН-] =10-8 моль/л.
Из полученных равенств видно, что ионы Fe2+ находятся в растворе, тогда как ионы Fe3+ находятся в осадке. Следовательно, при рН 6,0 потенциал
окислительно-восстановительной системы определяется только [Fe2+] при условии, что в растворе нет каких-либо органических веществ, сохраняющих подвижность [Fe3+].
Если этот раствор подкислить до рН 1,0, количество ионов [Fe2+] в растворе не изменится, а гидроксид железа (III) полностью растворится. В результате [Fe2+] = [Fe3+], а εh=ε0 .
Рассмотрим несколько подробнее, как зависит растворимость Fе(ОН)3 от рН среды. Из уравнения (4.148) имеем
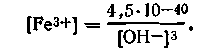
Заменяя значение [ОН-] на [Н+] из ионного произведения воды, получим
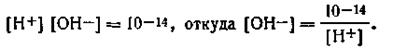
С учетом этого
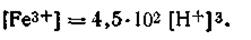
| 4.149 |
Логарифмируя выражение (4.149) получим
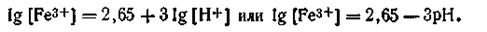
| 4.150 |
Таким образом, концентрация (активность) иона Fe3+ в растворе контролируется только величиной рН. Задаваясь произвольными значениями рН, можно составить таблицу активности иона Fe3+ в растворе (табл. 4.11).
Как видно из таблицы, растворимость гидроксида железа (III) при рН 1,0 практически безгранична. При повышении величины рН на единицу растворимость гидроксида железа (III) уменьшается в 1000 раз и уже при рН 3,0 активность иона Fe3+ измеряется стотысячными долями грамма на 1 л воды.
Таким образом, в подобных случаях рН, влияя на растворимость одного из компонентов окислительно-восстановительной системы, оказывает существенное влияние на ОВ-потенциал этой системы.
Дата добавления: 2016-02-20; просмотров: 2488;
