Окислительно-восстановительные реакции. Общие принципы реакционной способности органических соединений
Общие принципы реакционной способности органических соединений
Окислительно-восстановительные реакции (ОВР) сопровождаются переносом электронов от одной частицы к другой, в результате происходит изменение степени окисления атомов.Окисление – процесс отдачи электронов, восстановление процесс присоединения электронов.В ОВР органических соединений практически всегда носителем электронов является водород. Поэтому окисление сопровождается снижением доли водорода, а восстановление – увеличением водорода.
. Количественной мерой окислительно-восстановительной способности является величина восстановительного (редокс -) потенциала j. Чем выше редокс- потенциал j, тем сильнее окислительные свойства, чем он ниже, тем сильнее восстановительные свойства редокс- пары. Процесс передачи электронов всегда идет от реагента с меньшим j к реагенту с большим j. Величину редокс-потенциала измеряют относительно эталонной пары 2Н+/Н20 потенциал которой, в стандартных условиях, принят равным нулю j 0=0В. В организмах, где условия далеки от стандартных (рН =7) определяют «нормальный восстановительный потенциал j0¢», для пары 2Н+/Н2 j 0¢ = -0,42В.
В биологических системах ОВР делятся на ферментативные и свободнорадикальные. Ферментативное окисление может быть дегидрогеназным или оксигеназным. Дегидрогеназные ОВР сопровождаются изменением количества атомов водорода в молекуле, оксигеназные – изменением количества атомов кислорода.
Алкены окисляются до двухатомных спиртов (in vitro) и восстанавливаются до алканов (in vitro и in vivo), окисление водным раствором КMnO4 - качественная реакция на двойную связь
 |
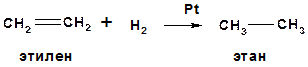 б) восстановление
б) восстановление
Метанол и первичные спирты обратимо окисляются до альдегидов (альдегиды восстанавливаются в первичные спирты), Альдегиды в дальнейшем легко окисляются до карбоновых кислот.
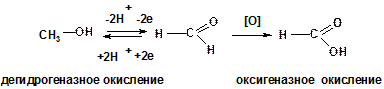
Вторичные спирты обратимо окисляются до кетонов (кетоны восстанавливаются во вторичные спирты)
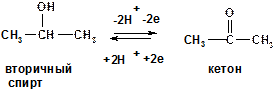
3) Третичные спирты устойчивы к окислению
Окислители: in vivo - кофермент НАД+ in vitro – K2Cr2O7,H+, t или CuO,
Восстановители: кофермент НАДН.
2. Фенолы.Обратимо окисляются в двухатомные кетоны – хиноны. Так двухатомный фенол гидрохинон окисляется в хинон, который легко восстанавливается в гидрохинон.
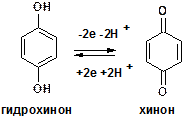
3. Тиолы.Обратимо окисляются до дисульфидов. Реакция идет в мягких условиях (кислородом воздуха и другими слабыми окислителями). Дисульфиды также легко восстанавливаются в тиолы.
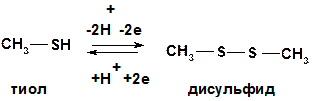 | ||
 |
4. Альдегиды окисляются до карбоновых кислот. Кетоны устойчивы к окислению.
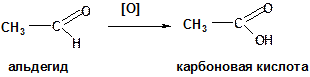 |
Окислители in vitro: Ag(NH3)2OH, t; Cu(OH)2, t и другие Это качественные реакции альдегидов, ( р. «серебряного зеркала», р. «медного зеркала»).
Альдегиды и кетоны восстанавливаются в спирты. Альдегиды в первичные, кетоны во вторичные спирты

Восстановители: In vivo кофермент НАДН in vitro LiAlH4
Реакции SR, Алканы и циклоалканы
Алканы и стабильные циклоалканы начиная с циклопентана вступают в реакции радикального замещения, так как имеют неполярные молекулы, которые содержат прочные сигма-связи.
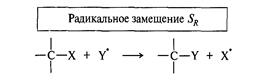
Пример: хлорирование метана
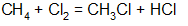
Дата добавления: 2016-04-06; просмотров: 2923;
