Окислительно-восстановительные реакции
Окислительно-восстановительные реакции - это реакции, которые идут с изменением степеней окисления элементов. Степень окисления - это условный заряд атома в молекуле, где все полярные связи считаются ионными.
Окисление - это процесс отдачи электронов.
Восстановление - это процесс присоединения электронов.
Окислитель - это атом, молекула или ион, который принимает электроны и понижает свою степень окисления, т.е. восстанавливается.
Восстановитель - это атом, молекула или ион, который отдаёт электроны и повышает свою степень окисления, т.е. окисляется.
Типичные восстановители и окислители
Восстановители: а) металлы - чем меньше потенциал ионизации, тем сильнее восстановительные свойства; б) соединения элементов в низших степенях окисления (NH3, H2S, HBr, HI и др.), у которых все орбитали заполнены и могут только отдавать электроны.
Окислители: а) неметаллы (F2, Cl2, Br2, O2 и др.) - чем больше сродство к электрону, тем сильнее окислительные свойства; б) ионы металлов в высоких степенях окисления (Fe3+, Sn4+, Mn4+ и др.); в) соединения элементов в высших степенях окисления (KMnO4, K2Cr2O7, NaBiO3, HNO3, H2SO4(конц.) и др.), у которых уже отданы все валентные электроны и могут быть только окислителями.
Соединения элементов в промежуточных степенях окисления (HNO2, H2SO3, H2O2 и др.) могут проявлять окислительные и восстановительные свойства в зависимости от окислительно-восстановительных свойств второго реагента.
H2SO3 + 2H2S = 3S + 3H2O
окисл. восст.
H2SO3 + Br2 + H2O = H2SO4 + 2HBr
восст. окисл.
Пример:
| Na0 | 3s1 | восстановитель (сильный) |
| Na+1 | 3s0 | окислитель (слабый) |
| F- | 2s22p6 | восстановитель (слабый) |
| F0 | 2s22p5 | окислитель (сильный) |
| S-2 | 3s23p6 | восстановитель |
| S0 | 3s23p4 | восстановитель, окислитель |
| S+4 | 3s23p0 | восстановитель, окислитель |
| S+6 | 3s03p0 | окислитель |
Окислители, принимая электроны, то есть, восстанавливаясь, переходят в восстановленную форму:
F2 + 2e ® 2F-
окисл. восст.
Восстановители, отдавая электроны, то есть, окисляясь, переходят в окисленную форму:
Na0 - 1e ® Na+
восст. окисл.
Таким образом, как окислители, так и восстановители существуют в окисленной (с более высокой степенью окисления элемента) и восстановленной (с более низкой степенью окисления элемента) формах. При этом для окислителей более характерен переход из окисленной в восстановленную форму, а для восстановителей характерен переход из восстановленной в окисленную форму. Обратные процессы не характерны, и мы не считаем, например, что F- является восстановителем, а Na+ - окислителем.
Равновесие между окисленной и восстановленной формами характеризуется с помощью окислительно-восстановительного потенциала, который зависит от концентраций окисленной и восстановленной форм, реакции среды, температуры и т.д. Его можно рассчитать по уравнению Нернста:
E = Eo + 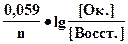
где [Oк.] - молярная концентрация окисленной формы;
[Восст.] - молярная концентрация восстановленной формы;
n - число электронов, участвующих в полуреакции;
Е0 - стандартное значение окислительно-восстановительного потенциала; Е = Е0, если [Восст.] = [Ок] = 1 моль/л;
Величины стандартных электродных потенциалов Е0 приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: Чем положительнее величина Е0, тем сильнее окислительные свойства, и чем отрицательнее значение Е0, тем сильнее восстановительные свойства.
Например:
F2 + 2e ® 2F- Е0 = 2,87 в - сильный окислитель
Na+ + 1e ® Na0 Е0 = -2,71 в - сильный восстановитель
(процесс всегда записывается для реакций восстановления).
Поскольку окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, то она характеризуется значением разности стандартных электродных потенциалов окислителя (Е0ок) и восстановителя (Е0восст) - электродвижущей силой (э.д.с.) DЕ0:
DЕ0 = Е0ок - Е0восст,
Э.д.с. реакции DЕ0 связана с изменением свободной энергии Гиббса DG : DG = -nFDЕ0 , а с другой стороны, DG связана с константой равновесия К реакции уравнением DG = -2,3RTlnK.
Из последних двух уравнений следует зависимость между э.д.с. и константой равновесия реакции:
DЕ = (2,3RT/nF)lnK.
Э.д.с. реакции при концентрациях отличных от стандартных (т.е. не равных 1 моль/л) DЕ равна:
DЕ = DЕ0 - (2,3RT/nF)lgK или DЕ = DЕ0 - (0,059/n)lgK.
В случае равновесия DG = 0 и следовательно DЕ =0. Откуда DЕ = (0,059/n)lgK и К = 10 nDЕ /0,059.
Для самопроизвольного протекания реакции должно выполняться требование: DG <0 или К>>1, которым соответствует условие DЕ0>0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение DЕ0. Если DЕ0>0, реакция идет. Если DЕ0<0, реакция не идет.
Пример 1. Определить возможность протекания реакции
2FeCl3 + 2KI ® 2FeCl2 + 2KCl + I2
Решение: Находим, что окислителем является ион Fe+3, восстанавливающийся до Fe+2, а восстановителем - I-, окисляющийся до I2. Находим по таблице значения стандартных электродных потенциалов: E0(Fe+3/Fe+2) = 0,77 в и E0(I2/2I-) = 0,54 в. Вычисляем DЕ0:
DЕ0 = Е0ок - Е0восст = 0,77 - 0,54 = 0,23 в >0.
Реакция возможна, так как DЕ0 > 0.
Пример 2. Определить возможность протекания реакции
2 KMnO4 + 16 HCl ® 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O.
Решение. Находим, что окислителем является перманганат-ион MnO4-, переходящий в Mn+2, а восстановителем - хлорид-ион, переходящий в газообразный хлор Cl2. Определяем по таблице их потенциалы: E0(MnO4-/Mn+2) = 1,51 в и E0(Cl2/2Cl-) = 1,36 в. Вычисляем
DЕ0 = Е0ок - Е0восст = 1,51 - 1,36 = 0,15 в >0.
Реакция возможна, так как DЕ0 > 0.
Классификация ОВР
1. Реакции межмолекулярного окисления-восстановления - окислитель и восстановитель входят в состав разных веществ:
2Fe + 3Cl2 = 2FeCl3
восст. окисл.
2. Реакции диспропорционирования - элемент в промежуточной степени окисления является окислителем и восстановителем:
2KOH + Cl2 = KCl + KClO + H2O
3HNO2 = HNO3 + 2NO + H2O
В этих реакциях хлор и N+3 являются окислителями и восстановителями.
3. Реакции внутримолекулярного окисления-восстановления - окислитель и восстановитель входят в состав одного вещества:
2KClO3 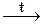 2KCl + 3O2
2KCl + 3O2
NH4NO3 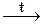 N2O + 2H2O
N2O + 2H2O
В этих реакциях О-2, Cl+5 и N-3, N+5 являются соответственно восстановителями и окислителями.
Следует отметить, что направление протекания ОВР и характер продуктов реакции зависят от окислительно-восстановительных свойств реагирующих веществ и характера среды (кислая, нейтральная или щелочная). Например, перманганат калия KMnO4, который проявляет только окислительные свойства, при переходе от кислой к нейтральной и щелочной среде образует разные продукты восстановления и его окислительно-восстановительный потенциал уменьшается:
pH < 7: MnO4- + 5e ® Mn+2 (бесцветный) Е0 = +1,51 в
pH = 7: MnO4- + 3e ® MnO2 (коричневый) Е0 = +0,60 в
pH > 7: MnO4- + 1e ® MnO4-2 (зеленый) Е0 = +0,56 в
Соединения хрома (VI) являются сильными окислителями в кислой среде (Е0 = +1,33 в), восстанавливаются до Cr+3, а соединения хрома (III) в щелочной среде проявляют восстановительную способность (Е0 = -0,13 в), окисляясь в соединения хрома (VI).
pH £ 7: Cr2O72- + 6e ® 2Cr+3 (синий)
pH > 7: CrO42- + 3e ® [Cr(OH)6]3- (зеленый)
Пероксид водорода Н2О2, содержащий кислород в промежуточной степени окисления -1, проявляет окислительные или восстановительные свойства, и в зависимости от рН раствора изменяются его электродный потенциал и продукты, до которых он восстанавливается или окисляется.
Н2О2 - окислитель:
рН > 7: Н2О2 + 2Н+ + 2e® 2Н2О
рН ³ 7: Н2О2 + 2e® 2ОН-
Н2О2 - восстановитель:
рН > 7: Н2О2 - 2e® О2+ 2Н+
рН ³ 7: Н2О2 + 2ОН- - 2e® О2 + 2Н2О
Таким образом, для правильного написания ОВР следует обязательно учитывать условия протекания данной реакции.
Ионно-электронный метод составления ОВР
Ионно-электронный метод (или метод полуреакций) используется для составления ОВР протекающих в растворах. Основан он на составлении отдельных полуреакций для процессов восстановления и окисления в виде ионно-молекулярных уравнений. При этом необходимо учитывать правила написания ионных уравнений реакций: сильные электролиты записываются в виде ионов, а слабые электролиты и малорастворимые вещества - в виде молекул.
Порядок составления ОВР
1. Записывается левая часть молекулярного уравнения ОВР, определяется окислитель и восстановитель.
2. Записываются полуреакции отдельно для процессов восстановления и окисления в виде ионно-молекулярных уравнений, в которых левая и правая часть (избыток или недостаток кислорода в левой части) уравниваются с учетом рН раствора с помощью молекул Н2О, ионов Н+ или ОН-:
рН < 7: избыток [O] 2H+ + [O] ® H2O
недостаток [O] H2O - [O] ® 2H+
рН = 7: избыток [O] H2O + [O] ® 2OH-
недостаток [O] H2O - [O] ® 2H+
рН > 7: избыток [O] H2O + [O] ® 2OH-
недостаток [O] 2OH- - [O] ® H2O.
3. Суммы зарядов в левой и правой частях полуреакций уравниваются путем прибавления или отнятия электронов. После этого подбираются множители к полуреакциям.
4. Записывается суммарное ионно-молекулярное уравнение ОВР с учетом множителей.
5. Дописывается правая часть молекулярного уравнения ОВР и переносятся в него коэффициенты из ионно-молекулярного уравнения.
Пример 1. Взаимодействие KMnO4 c Na2SO3 в кислой среде.
1. Записываем левую часть уравнения, определяем окислитель и восстановитель:
KMnO4 + Na2SO3 + H2SO4 =
окисл. восст. среда
2. Составляем полуреакции для процессов восстановления и окисления с учетом кислой среды. В кислой среде перманганат ион MnO4- восстанавливается до иона Mn2+, а сульфит ион SO32- окисляется до сульфат иона SO42-:
MnO4- ® Mn+2 - избыток кислорода связываем ионами Н+,
SO32- ® SO42- - недостающий кислород берем из воды и выделяются ионы Н+.
Получаем следующие полуреакции:
MnO4- + 8Н+ ® Mn+2 + 4Н2О
SO32- + Н2О ® SO42- + 2Н+
3. Считаем суммы зарядов в левой и правой частях обеих полуреакций и уравниваем заряды с помощью электронов, подбираем множители:
2 |MnO4- + 8Н+ + 5e ® Mn+2 + 4Н2О
5 |SO32- + Н2О - 2e ® SO42- + 2Н+
4. Записываем суммарное ионно-молекулярное уравнение ОВР с учетом множителей:
2 |MnO4- + 8Н+ + 5e ® Mn+2 + 4Н2О
5 |SO32- + Н2О - 2e ® SO42- + 2Н+
2MnO4- + 16Н+ + 5SO32- + 5Н2О ® 2Mn+2 + 8Н2О + 5SO42- + 10Н+
Сокращаем ионы водорода и молекулы воды и получаем:
2MnO4- + 6Н+ + 5SO32- ® 2Mn+2 + 3Н2О + 5SO42-
5. Дописываем правую часть молекулярного уравнения и переносим в него коэффициенты и ионно-молекулярного. Итоговое уравнение будет иметь следующий вид:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2 |MnO4- + 8Н+ + 5e ® Mn+2 + 4Н2О
5 |SO32- + Н2О - 2e ® SO42- + 2Н+
2MnO4- + 6Н+ + 5SO32- ® 2Mn+2 + 3Н2О + 5SO42-
Пример 2. Окисление нитрата хрома (III) пероксидом водорода в щелочной среде - качественная реакция на ион Cr3+. В щелочной среде ион Cr3+ окисляется до хромат иона CrO42-, имеющего желтую окраску.
2Cr(NO3)3 + 3Н2О2 + 10KOH ® 2K2CrO4 + 6KNO3 + 8H2О
2|Cr3+ + 8OH- - 3e ® CrO42- + 4H2O
3|H2O2 + 2e ® 2OH-
2Cr3+ + 10OH- + 3Н2О2 ® 2CrO42- + 8Н2О
Дата добавления: 2016-04-11; просмотров: 3149;
