Химия элементов IIA группы.
Элементы IIA группы имеют электронную формулу ns2. Все они являются металлами, сильными восстановителями, несколько менее активным, чем щелочные металлы. Для них характерна степень окисления +2 и валентность 2. При образовании ковалентной связи происходит s®p возбуждение электрона и sp-гибридизация АО. Элементы IIA группы можно разделить на три части: 1) щелочноземельные металлы Ca, Sr, Ba, Ra, основания которых являются щелочами, 2) Мg, основание которого мало растворимо в воде, 3) Ве, основание которого является амфотерным основанием. В природе элементы IIA группы находятся в виде солей: сульфатов, карбонатов, фосфатов, силикатов. Эти элементы получают электролизом расплавов их солей. Элементы IIA группы представляют собой легкие серебристые металлы, более твердые, чем щелочные металлы.
Химические свойства элементов
Элементы IIA группы - менее активные восстановители, чем щелочные металлы. Их восстановительные свойства увеличиваются от бериллия к радию. Кислород воздуха окисляет Ca, Sr, Ba, Ra при обычной температуре. Mg и Be покрыты оксидными пленками и окисляются кислородом только при нагревании:
2Ca + O2 ® 2CaO
2Mg + O2 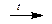 2MgO
2MgO
Активные восстановители, металлы IIA группы, реагируют с неметаллами (например, с хлором), водой, кислотами:
Ca + Cl2 ® CaCl2
Ca+ 2H2O ® Ca(OH)2 + H2
Mg+ 2HCl ® MgCl2 + H2
4Mg + 10HNO3(разб.) ® 4Mg(NO3)2 + NH4NO3 + 3H2O
Химические свойства соединений
Гидриды щелочноземельных металлов являются ионными солеобразными соединениями и взаимодействуют с водой и кислотами:
CaH2 + 2H2O ® Ca(OH)2 + 2H2
CaH2 + 2HCl ® CaCl2 + 2H2
Оксиды щелочноземельных металлов Ca, Sr, Ba, Ra растворяются в воде c образованием щелочей. Оксид магния - мало растворим в воде и имеет только основные свойства. Нерастворимый в воде оксид бериллия имеет амфотерные свойства.
BeO + H2O ¹
BeO + 2HCl ® BeCl2 + H2O
BeO + 2NaOH 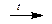 Na2BeO2
Na2BeO2
MgO + H2O ¹
MgO + 2HCl ® MgCl2 + H2O
MgO + NaOH ¹
CaO + H2O ® Ca(OH)2
CaO + CO2 ® CaCO3
CaO + 2HCl ® CaCl2 + H2O
Гидроксиды Ca, Sr, Ba, Ra являются щелочами, гидроксид Mg - малорастворимый основной гидроксид, гидроксид Be - амфотерный гидроксид.
Be(OH)2¯ + 2HCl ® BeCl2 + 2H2O
Be(OH)2¯ + 2NaOH ® Na2[Be(OH)4]
Mg(OH)2¯ + 2HCl ® MgCl2 + 2H2O
Ba(OH)2 + 2HCl ® BaCl2 + 2H2O
Ba(OH)2 + CO2 ® BaCO3¯ + H2O
Ba(OH)2 + H2SO4 ® BaSO4¯ + 2H2O
Карбонаты и сульфаты элементов IIA группы малорастворимы в воде. Карбонаты растворяются в кислотах:
CaCl2 + Na2CO3 ® CaCO3¯+ 2NaCl
CaCO3 + 2HCl ® CaCl2 + H2O + CO2
Содержание ионов Ca2+ и Mg2+ обуславливает жесткость воды: временную, если есть гидрокарбонаты Ca и Mg, и постоянную, если в воде есть хлориды или сульфаты Ca и Mg. При кипячении жесткая вода смягчается за счет уменьшения временной жесткости воды:
Ca(HCO3)2 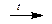 CaCO3¯ + H2O + CO2
CaCO3¯ + H2O + CO2
Жесткость воды (Ж) измеряется в миллимолях эквивалентов солей в 1 литре воды: Ж = 1000´Сэ , где Сэ - молярная концентрация эквивалентов (нормальность) солей в воде.
Соли BaCl2 и BaCO3 ядовиты и используются в качестве инсектицидов. Магний является важным конструкционным материалом, является микроэлементом, входит в состав хлорофилла. Гашеная известь используется в строительстве. Соли кальция, например, CaSO4´2H2O - гипс - используется для гипсования засоленных почв.
Химия р-элементов
В атомах р-элементов электроны заполняют р-подуровень внешнего уровня. В периодической системе есть 30 р-элементов. У атомов р-элементов, расположенных в главных подгруппах III - VIII групп. У р-элементов являются валентными не только р-, но и S-электроны внешнего уровня. Высшая степень окисления атомов р-элементов равна номеру группы.
Дата добавления: 2016-04-11; просмотров: 1844;
