Химия элементов VIIA группы
Атомы галогенов, образующих VIIA группу, имеют электронную конфигурацию ns2np5. Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F>Cl>Br>I>At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. Электронная формула атома водорода 1s1. С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s2. Поэтому часто водород располагают вместе с галогенами в VIIA группе.
Химия водорода и его соединений
Водород занимает особое положение среди других элементов периодической системы. Подобно атомам щелочных металлов атом водорода способен отдавать один электрон, проявляя восстановительные свойства, и образовывать положительно заряженный ион. Подобно галогенам, водород может проявлять и окислительные свойства и образовывать гидриды, например, NaH, сходные с соответствующими галогенидами. Водород, подобно галогенам, образует двухатомные молекулы Н2. В органических соединениях атомы галогенов могут замещать атомы водорода: CH4 - CH3Cl - CH2Cl2 и т.д. Отсутствие внутренних электронных оболочек у атома водорода обуславливает его способность к образованию водородных связей.
В промышленности водород получают конверсией природного газа в присутствии катализатора при температуре 800-900оС:
2CH4 + 2H2O + O2 ® 6H2 + 2CO2
В лаборатории водород получают действием соляной кислоты на цинк в аппарате Киппа:
Zn + 2HCl ® ZnCl2 + H2
Водород представляет собой легкий газ без цвета, без запаха. Водород растворяется в некоторых металлах: в одном объеме палладия растворяется 900 объемов водорода.
Окислительные свойства водород проявляет при взаимодействии с активными металлами с образованием ионных солеобразных гидридов:
Н2 + 2Li ® 2LiН
Восстановительные свойства водород проявляет при взаимодействии с неметаллами:
Н2 + Cl2 ® 2HCl
3Н2 + N2 ® 2NH3
Смесь водорода и кислорода загорается со взрывом, чистый водород горит беззвучно.
2Н2 + О2 ® 2H2О
Гидриды активных металлов разлагаются при действии воды или кислот:
NaH + H2O ® NaOH + H2
CaH2 + 2HCl ® CaCl2 + 2H2
Химия фтора и его соединений
Фтор является наиболее активным неметаллом, сильным окислителем. Фтор - зеленовато-желтый газ с резким запахом. В атмосфере фтора горят многие металлы и неметаллы с образованием соответствующих фторидов. Фтор взаимодействует с водородом с взрывом в темноте и при низких температурах:
F2 + H2 ® 2HF
Фтор взаимодействует с водой:
2F2 + 2H2O ® 4HF + O2
Фтор вытесняет хлор из хлоридов:
F2 + 2NaCl ® 2NaF + Cl2
Фтороводородная (плавиковая) кислота является слабой кислотой. Молекулы HF связаны друг с другом водородными связями, образуя молекулы HnFn, где n=2-6, поэтому плавиковая кислота может образовывать кислые соли, например, KHF2. Фтороводородная кислота ядовита, вызывает ожоги кожи. Плавиковая кислота разрушает стекло, реагируя с оксидом кремния (IV) с образованием газообразного SiF4:
4HF + SiO2 ® SiF4 + 2H2O
Химия хлора и его соединений
В природе хлор находится в виде хлоридов. В промышленности хлор получают вместе с водородом и гидроксидом натрия при электролизе водного раствора хлорида натрия:
2NaCl + 2H2O 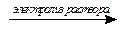 H2 + Cl2 + 2NaOH
H2 + Cl2 + 2NaOH
В лаборатории хлор получают при взаимодействии перманганата калия с концентрированной соляной кислотой:
2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Хлор - тяжелый газ желто-зеленого цвета с резким запахом. Раствор пяти объемов хлора в одном объеме воды называют хлорной водой. Активный окислитель хлор взаимодействует с водородом на свету:
Cl2 + H2 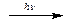 2HCl
2HCl
Хлороводород - бесцветный газ с резким запахом, хорошо растворим в воде: в 1 объеме воды при 0оС растворяется более 500 объемов хлороводорода. Раствор хлороводорода в воде называют хлороводородной соляной кислотой. Это сильная кислота, ее соли - хлориды.
При взаимодействии хлора с водой и щелочами происходит диспропорционирование хлора, и наряду с соляной кислотой образуются кислородосодержащие кислоты хлора или их соответствующие соли:
Cl2 + H2O ® HCl + HClO
2Cl2 + 2Ca(OH)2 ® CaCl2 + Ca(ClO)2 + 2H2O
Смесь хлорида и гипохлорита кальция (CaCl2 + Ca(ClO)2) называют хлорной или белильной известью. Хлор в количестве 1,5 г на 1м3 воды используется для обеззараживания воды. Образующаяся при этом хлорноватистая кислота HClO разлагается с образованием атомарного кислорода (HClO ® HCl + O), который, являясь активным окислителем, убивает микробы, обесцвечивает краски и т.д.
В ряду кислородосодержащих кислот хлора: HClO, HClO2, HClO3, HClO4 - с увеличением степени окисления хлора растет сила кислот, а их окислительная активность уменьшается.
Химия брома, иода и их соединений
В природе бром и иод находятся в виде солей (NaBr, NaI и др.). Их получают действием хлора на растворы этих солей:
2NaBr + Cl2 ® 2NaCl + Br2
2NaI + Cl2 ® 2NaCl + I2
Если хлор - газ, то бром - темно-бурая жидкость с резким запахом, а иод - кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного - дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор ® бром ® иод.
Бром и иод взаимодействуют со многими металлами:
2Al + 3Br2 ® 2AlBr3
2Al + 3I2 ® 2AlI3
Окислительная способность галогенов уменьшается от фтора к иоду. Так взаимодействие брома с водородом идет лишь при температуре более 300оС, а взаимодействие иода с водородом не идет до конца и является обратимым процессом:
Br2 + H2 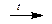 2HBr
2HBr
I2 + H2  2HI
2HI
Растворы бромоводорода и иодоводорода в воде являются сильными кислотами. Сила кислот растет в ряду HCl - HBr - HI в связи с увеличением размеров и поляризуемостей этих молекул. Соли этих кислот (бромиды и иодиды) хорошо растворимы в воде. Лишь галогениды серебра малорастворимы в воде.
AgNO3 + NaBr ® AgBr¯ + NaNO3
AgNO3 + NaI ® AgI¯ + NaNO3
Бром и иод хорошо растворимы в органических растворителях и могут быть экстрагированы ими из водных растворов. Раствор брома в толуоле или четыреххлористом углероде оранжевый, раствор иода - фиолетовый. С крахмалом иод дает темно-синее окрашивание, исчезающее при нагревании и появляющееся вновь при охлаждении. Восстановительные свойства галогенид-ионов увеличиваются в ряду Cl- ® Br- ® I- и иодид-ион является сильным восстановителем.
10KI + 8H2SO4 + 2KMnO4 ® 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
Химия d-элементов
В атомах d-элементов (переходных элементов) заполняется электронами d-подуровень предвнешнего уровня. На внешнем уровне атомы d-элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро- и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент.
Химия хрома и его соединений
В природе хром находится в виде хромового железняка FeO×Cr2O3
или Fe(CrO2)2. Хром получают восстановлением хромового железняка углем в электрических печах в виде феррохрома, содержащего 60-65% хрома:
FeO×Cr2O3 + 4CO ® Fe + 2Cr + 4CO2
Чистый хром может быть получен электролизом растворов или расплавов солей, методом алюминотермии из оксида хрома(III):
Cr2O3 + 2Al 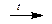 2Cr + Al2O3
2Cr + Al2O3
Хром представляет собой ковкий тягучий металл серо-стального цвета.
В степени окисления +2 соединения хрома проявляют основные свойства и являются восстановителями - легко окисляются до более высоких степеней окисления.
Оксид хрома(III) может быть получен разложением дихромата аммония при нагревании:
(NH4)2Cr2O7 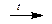 N2 + Cr2O3 + 4H2O
N2 + Cr2O3 + 4H2O
Соответствующий ему нерастворимый гидроксид хрома (III) получают при действии недостатка щелочей на соли хрома(III):
СrCl3 + 3NaOH ® Cr(OH)3¯ + 3NaCl
Серо-зеленый гидроксид хрома (III) имеет амфотерные свойства:
Cr(OH)3¯ + 3HCl ® CrCl3 + 3H2O
Cr(OH)3¯ +3NaOH ® Na3[Cr(OH)6]
Соединения хрома (III) в щелочной среде имеют восстановительные свойства и окисляются бромом, пероксидом водорода или другими окислителями. Зеленый раствор гексагидроксохромата(III) натрия желтеет вследствие образования хромата натрия:
2Na3[Cr(OH)6] + 4NaOH + 3Br2 ® 2Na2CrO4 + 6NaBr + 8H2O
Оксид хрома(VI) имеет кислотные свойства. Ему соответствуют две кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7:
CrO3 + H2O ® H2CrO4
2CrO3 + H2O ® H2Cr2O7
В водных растворах между желтыми хромат ионами и оранжевыми дихромат ионами наблюдается равновесие:
2CrO42- + 2H+ ® Cr2O72- + H2O
Это равновесие в кислой среде сдвигается в сторону образования дихромат-ионов, а в щелочной среде - в сторону хромат-ионов:
2K2CrO4 + H2SO4 ® K2Cr2O7 + K2SO4 + H2O
K2Cr2O7 + 2KOH ® 2K2CrO4 + H2O
Существующие в кислой среде дихроматы являются сильными окислителями, восстанавливаясь до соединений хрома(III):
K2Cr2O7 + 4H2SO4 + 3K2SO3 ® Cr2(SO4)3 + 4K2SO4 + 4H2O
K2Cr2O7 + 7H2SO4 + 6KI ® Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
Химия марганца и его соединений
Так же, как и хром, в природе марганец встречается в виде оксидов: пиролюзита MnO2, гаусманита Mn3O4, браунита Mn2O3. Встречается марганец и в железных рудах. Совместным восстановлением железных и марганцевых руд получают ферромарганец, содержащий 80-85% марганца и используемый в производстве стали и чугуна. Чистый марганец получают алюминотермией или электролизом растворов сульфата или хлорида марганца.
Марганец - серебристо-белый твердый и хрупкий металл. Марганец вытесняет водород из соляной кислоты, реагирует с серной и азотной кислотами:
Mn + 2HCl ® MnCl2 + H2
Mn + 2H2SO4 ® MnSO4 + SO2 + 2H2O
3Mn + 8HNO3 (1:1) ® 3Mn(NO3)2 + 2NO + 4H2O
Марганец образует несколько оксидов. С повышением степени окисления марганца, свойства этих оксидов изменяются: оксиды марганца (II и III) - основные, оксид марганца (IV) - амфотерный, оксиды марганца (VI и VII) - кислотные.
Нерастворимый в воде гидроксид марганца (II) может быть получен действием щелочей на соли марганца:
MnSO4 + 2NaOH ® Mn(OH)2¯ + Na2SO4
Гидроксид марганца(II) имеет основные свойства (но не кислотные):
Mn(OH)2¯ + 2NaOH ¹
Mn(OH)2¯ + H2SO4 ® MnSO4 + 2H2O
а также восстановительные свойства, он окисляется на воздухе:
2Mn(OH)2¯ + O2 ® MnO2¯ + 2H2O
Действием сильных окислителей, таких как висмутат натрия NaBiO3 или оксид свинца(IV) PbO2, соли марганца(II) могут быть окислены в кислой среде до фиолетовой марганцовой кислоты HMnO4.
2Mn(NO3)2 + 16HNO3 + 5NaBiO3 ® 2HMnO4 + 5Bi(NO3)3 +
+ 5NaNO3 + 7H2O
Устойчивый оксид марганца(IV) MnO2 имеет амфотерные свойства и растворяется в кислотах и щелочах. В кислой среде MnO2 является сильным окислителем, способным выделить хлор из соляной кислоты:
MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
Оксид марганца(VI) MnO3 и соответствующая ему марганцовистая кислота H2MnO4 неустойчивы. Несколько более устойчивы соли этой кислоты - манганаты, например, K2MnO4, имеющие в растворах зеленый цвет.
Марганцовая кислота HMnO4 и соответствующие ей соли - перманганаты, например, KMnO4, имеют в растворах характерный фиолетовый цвет. Пеманганаты являются сильными окислителями, особенно в кислой среде. Продуктами восстановления перманганат-ионов могут быть ионы Mn2+ (бесцветный раствор в кислой среде), черно-бурый осадок MnO2 (в нейтральной или слабощелочной среде) или ионы MnO42- (зеленый раствор в сильнощелочной среде):
2KMnO4 + 3H2SO4 + 5Na2SO3 ® 2MnSO4 + 5Na2SO4 + K2SO4 +
+ 3H2O
2KMnO4 + H2O + 3Na2SO3 ® 2MnO2 + 3Na2SO4 + 2KOH
2KMnO4 + 2KOH + Na2SO3 ® 2K2MnO4 + Na2SO4 + H2O
Химия железа и его соединений
Железо является вторым после алюминия металлом по распространенности в природе. Основные руды: магнетит Fe3O4, гематит Fe2O3, лимонит 2Fe2O3×3H2O, пирит FeS2. Из руд железо получают восстановлением углеродом в домнах. Получаемое при этом железо содержит около 4% углерода и называется чугуном. При переработке чугуна получают стали, в которых содержание углерода составляет 0,2-2,0%.
Железо является достаточно активным металлом и растворяется в соляной и разбавленных азотной и серной кислотах.
Fe + 2HCl ® FeCl2 + H2
Fe + H2SO4 (разб.) ® FeSO4 + H2
Fe + HNO3 (разб.) ® Fe(NO3)3 + NO + H2O
Концентрированные серная и азотная кислоты на холоду пассивируют железо (как и алюминий, и хром)
Нерастворимый в воде оксид железа(II) FeO имеет основные свойства и растворяется в кислотах, но не в щелочах:
FeO + H2O ¹
FeO + H2SO4 ® FeSO4 + H2O
Зеленоватый осадок гидроксида железа(II) Fe(OH)2 получают действием щелочей на соли железа(II).
FeSO4 + 2NaOH ® Fe(OH)2¯ + Na2SO4
Fe(OH)2 имеет основные свойства:
Fe(OH)2¯ + Н2SO4 ® FeSO4 + 2H2O
Fe(OH)2¯ + 2NaOH ¹
и легко окисляется кислородом воздуха до бурого гидроксида железа (III), проявляя восстановительные свойства:
4Fe(OH)2¯ + 2H2O + O2 ® 4Fe(OH)3¯
Красно-бурый осадок гидроксида железа(III) Fe(OH)3 получают действием щелочей на соли железа(III).
FeCl3 + 3NaOH ® Fe(OH)3¯ + 3NaCl
Гидроксид железа (III) имеет амфотерные свойства. Его основные свойства слабее, чем у Fe(OH)2, а его кислотные свойства слабее его основных свойств и проявляются лишь в очень жестких условия, например, при сплавлении.
Fe(OH)3¯ + 3HCl ® FeCl3 + 3H2O
Fe(OH)3¯ + NaOH ¹ не идет в растворе
Fe(OH)3¯ + NaOH 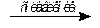 NaFeO2 + H2O
NaFeO2 + H2O
В кислой среде ионы железа(III) являются окислителями и переходят в ионы железа(II):
FeCl3 + 2HI ®2FeCl2 + I2 + 2HCl
В щелочной среде сплавлением с нитратом калия из соединений железа(III) могут быть получены соединения железа(III) - соли железной кислоты - ферраты:
Fe2O3 + 3KNO3 + 4KOH 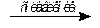 2K2FeO4 + 3KNO2 + 2H2O
2K2FeO4 + 3KNO2 + 2H2O
Ионы железа(II) и железа(III) образуют многочисленные комплексные соединения с молекулами воды, аммиака, ионами Cl-, F-, CN-, SCN- и другими лигандами:
FeSO4 + 6KCN ® K4[Fe(CN)6] + K2SO4
FeCl3 + 6KCN ® K3[Fe(CN)6] + 3KCl
Интенсивная кроваво-красная окраска роданида железа(III) Fe(SCN)3 служит для обнаружения ионов железа(III) в растворе.
FeCl3 + 3KCNS ® Fe(SCN)3 + 3KCl
Гексациано(II)феррат калия K4[Fe(CN)6] образует с ионами железа(III) темно-синий осадок берлинской лазури, что также используется для обнаружения ионов железа(III) в растворе:
K4[Fe(CN)6] + FeCl3 ® KFe[Fe(CN)6]¯ + 3KCl
Гексациано(III)феррат калия K3[Fe(CN)6] образует с ионами железа(II) темно-синий осадок турнбулевой сини, что используется для обнаружения ионов железа(II) в растворе:
K3[Fe(CN)6] + FeSO4 ® KFe[Fe(CN)6]¯ + K2SO4
Биологическое значение железа велико, железо - составная часть гемоглобина крови.
Химия меди и ее соединений
В природе медь находится в основном в виде соединений: халькозина Cu2S, ковелина CuS, куприта Cu2O, малахита (CuOH)2CO3 и других соединений, но встречается и в самородном состоянии. Получение обычно складывается из нескольких этапов: обжига сульфидов, восстановления полученных оксидов углем и рафинирования меди:
2CuS + 3O2 ® 2SO2 + 2CuO
CuO + СО ® Cu + СО2
Медь - мягкий красный металл, хорошо проводит тепло и электрический ток. Медь образует сплавы: латунь (60-90% Cu и 10-40% Zn), бронзы (например, 80% Cu, 15%Sn, 5% Zn), мельхиор (80% Cu, 20% Ni) и другие сплавы.
Медь расположена в ряду напряжений после водорода и не реагирует с обычными кислотами в отсутствии окислителей:
Cu + H2SO4 (разб.) ¹
Cu + HСl ¹
Однако медь реагирует с кислотами окислителями:
Cu + 2H2SO4 (конц.) ® CuSO4 + SO2 + 2H2O
Cu + 4HNO3 (конц.) ® Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (разб.) ® 3Cu(NO3)2 + 2NO + 4H2O
Красный оксид меди(I) Cu2O образуется при нагревании до 200оС меди на воздухе при недостатке кислорода. Соответствующий оксид CuOH нестоек, распадаясь на оксид и воду, и легко окисляется до Cu(OH)2. Из соединений меди(I) устойчивы лишь комплексные соединения, например, [Cu(NH3)2]OH или H[Cu(CN)2], или малорастворимые вещества, например белый CuI.
Черный оксид меди(II) CuO получается при нагревании меди на воздухе выше 300оС при избытке кислорода. При нагревании выше 1000оС CuO распадается на Cu2O и кислород.
Голубой осадок гидроксида меди(II) Cu(OН)2 получают действием щелочей на соли меди(II):
CuSO4 + 2NaOH ® Cu(OН)2¯ + Na2SO4
При нагревании этот осадок чернеет вследствие образования черного оксида меди(II):
Cu(OН)2¯ 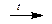 СuO + H2O
СuO + H2O
Гидроксид меди(II) Cu(OН)2 имеет амфотерные свойства с преобладанием основных свойств. Кислотные свойства Cu(OН)2 не наблюдаются в растворах, но проявляются при сплавлении или действии концентрированных щелочей:
Cu(OН)2¯ + Н2SO4 ® CuSO4 + 2H2O
Cu(OН)2¯ + NaOH ¹ не идет в растворе
Cu(OН)2¯ + 2NaOH (конц.) ® Na2[Cu(OH)4]
Ионы меди(II) образуют комплексные соединения. Так, образование интенсивно-синего тетраммина меди(II) используется для обнаружения ионов меди(II) в растворе:
CuSO4 + 4NH4OH ® [Cu(NH3)4]SO4 + 4H2O
Соли меди(II) имеют вследствие гидролиза кислую среду:
2CuSO4 + 2H2O  (CuOH)2SO4 + H2SO4
(CuOH)2SO4 + H2SO4
Cu2+ + SO42- + H2O  CuOH+ + H+ + SO42-
CuOH+ + H+ + SO42-
Cu2+ + H2O  CuOH+ + H+ (pH<7)
CuOH+ + H+ (pH<7)
Окислительные свойства для ионов меди(II) мало характерны, но проявляются при взаимодействии с иодид-ионом:
2CuSO4 + 4KI ® 2CuI¯ + I2 + 2K2SO4
Медь является микроэлементом. В больших концентрациях соединения меди токсичны и используются как пестициды.
Химия цинка и его соединений
В природе цинк находится в виде сульфидных руд, например, сфалерита ZnS. Получение цинка включает обжиг сульфидов до оксида цинка и дальнейшее восстановление оксида цинка углем:
2ZnS + 3O2 ® 2SO2 + 2ZnO
ZnO + СО ® Zn + СО2
Цинк может быть получен и электролизом растворов солей цинка, например, раствора сульфата цинка.
Цинк - синевато-белый пластичный и тягучий металл. Он находится в ряду напряжений до водорода (и до железа) и весьма активен. Для цинка в соединениях характерна лишь одна степень окисления +2. Цинк обычно покрыт защитной оксидной пленкой, разрушаемой при действии кислот и щелочей:
Zn + 2HCl ® ZnCl2 + H2
Zn + H2SO4 (разб.)® ZnSO4 + H2
4Zn + 5H2SO4 (конц.) ® 4ZnSO4 + H2S (или S¯) + 4H2O
4Zn + 10HNO3 (конц.) ® 4Zn(NO3)2 + N2O (и бурый NO2) + 5H2O
4Zn + 10HNO3 (оч.разб.) ® 4Zn(NO3)2 + NH4NO3) + 3H2O
Zn + 2NaOH + 2H2O ® Na2[Zn(OH)4]
Белый осадок гидроксида цинка Zn(OH)2 получают действием недостатка щелочей на соли цинка:
ZnSO4 + 2NaOH ® Zn(OH)2¯ + Na2SO4
Гидроксид цинка имеет амфотерные свойства и растворяется в кислотах и щелочах:
Zn(OH)2¯ + H2SO4 ® ZnSO4 + 2H2O
Zn(OH)2¯ + 2NaOH ® Na2[Zn(OH)4]
Гидроксид цинка (в отличии от гидроксида алюминия) растворим и в растворе аммиака с образованием комплексного соединения:
Zn(OH)2¯ + 6NH4OH ® [Zn(NH3)6](OH)2 + 6H2O
Соли цинка гидролизуются:
2ZnSO4 + 2H2O  (ZnOH)2SO4 + H2SO4
(ZnOH)2SO4 + H2SO4
Zn2+ + SO42- + H2O  ZnOH+ + H+ + SO42-
ZnOH+ + H+ + SO42-
Zn2+ + H2O  ZnOH+ + H+ (pH<7)
ZnOH+ + H+ (pH<7)
Цинк является микроэлементом, при его недостатке нарушается обмен белков и углеводов.
Дата добавления: 2016-04-11; просмотров: 1860;
