Химия элементов VA группы
Элементы VA группы имеют электронную формулу ns2np3. Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э2О5 имеют кислотные свойства, свойства оксидов Э2О3 : кислотные - для N и P, амфотерные - для As и Sb, основные - для Bi.
Свойства азота и его соединений
Азот находится в природе в свободном состоянии в виде N2 (78% атмосферы). Связанный азот накапливается в растительном и животном мире - в организмах животных, например, от1 до 10% азота. Все важнейшие части клеток построены из белковых веществ. Без белка нет жизни, а без азота нет белка.
В промышленности азот получают сжижением воздуха, при последующем нагревании которого первым испаряется азот (tкип = -195,8оС) и лишь после него - кислород (tкип = -183,0оС).
При обычных температурах азот химически инертен, вследствие большой прочности его двухатомных молекул N2, имеющих тройную связь. Азот используется в промышленности для синтеза аммиака и дальнейшего получения азотных удобрений. Синтез аммиака идет при 320 - 1000 атм., при 500-550оС на железном катализаторе.
N2 + 3H2 ® 2NH3 ; H = -46,36кДж/моль
Соединение азота в степени окисления -3 - аммиак NH3 - является бесцветным газом с резким запахом. Аммиак ядовит, легче воздуха, хорошо растворим в воде (в 1 объеме воды при 20оС растворяется 710 объемов аммиака) с образованием гидроксида аммония, который считается слабым основанием (К = 1,79×10-5):
NH3 + H2O ® NH3×H2O  NH4OH ® NH4+ + OH-
NH4OH ® NH4+ + OH-
Основные свойства аммиака проявляются и в реакциях с кислотами:
NH3 + НСl ® NH4Cl
Аммиак имеет восстановительные свойства (азот - в низшей степени окисления), реагируя с кислородом до азота при горении аммиака на воздухе или до NO в присутствии платинового катализатора при 600оС.
4NH3 + 3O2 ® 2N2 + 6H2O
4NH3 + 5O2  4NO + 6H2O
4NO + 6H2O
Наличие у атома азота в молекуле аммиака неподеленной пары электронов обуславливает донорные свойства аммиака, образующего комплексные соединения - аммиакаты:
CuSO4 + 4NH3 ® [Cu(NH3)4]SO4
Cоли аммония при нагревании разлагаются:
NH4Cl ® NH3 + HCl
NH4NO2 ® N2 + 2H2O
NH4NO3 ® N2O + 2H2O
В последней реакции мы получаем оксид азота (I) - N2O, называемый “веселящим” газом. Это безразличный оксид, разлагающийся при нагревании на азот и кислород. Безразличным оксидом является также и оксид азота(II) - NO, получаемый по следующим реакциям:
N2 + O2 ® 2NO при t>1000oC
3Cu + 8HNO3(разб.) ® 3Cu(NO3)2 + 2NO + 4H2O
Оксид азота(II) - NO, бесцветный газ, является восстановителем и легко окисляется кислородом, воздуха до оксида азота(IV) - NO2.
2NO + O2 ® 2NO2
Оксида азота(IV) - NO2 - газ бурого цвета, ядовит. При охлаждении димеризуется в бесцветный оксид N2O4. NO2 - сильный окислитель: уголь, сера, фосфор горят в нем, а оксид серы(IV) SO2 окисляется до оксида серы(VI) SO3. Оксида азота(IV) взаимодействует с водой и щелочами, проявляя кислотные свойства. При этом N+4 диспропорционирует на N+5 и N+3:
2NO2 + H2O ® HNO3 + HNO2
2NO2 + 2NaOH ® NaNO3 + NaNO2 + H2O
Оксид азота (III) N2O3 существует лишь при низких температурах. При t = 3,5oC кипит и разлагается:
N2O3 ® NO2 + NO
Этому оксиду соответствует слабая азотистая кислота HNO2 (K=4×10-4), которая существует лишь в разбавленных растворах и легко разлагается:
2HNO2 ® NO2 + NO + H2O
Соли азотистой кислоты - нитриты - устойчивы, для них характерны как окислительные, так и восстановительные свойства (азот - в промежуточной степени окисления):
2NaNO2 + 2KI + 2H2SO4 ® I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
2KMnO4 + 3H2SO4 + 5NaNO2 ® 2MnSO4 + NaNO3 + K2SO4 + 3H2O
Разложение иодида азота(III) происходит с взрывом:
2NI3 ® N2 + 2I2
Гидратным соединением оксида азота(V) N2O5 является азотная кислота HNO3. Получение азотной кислоты и ее солей основано на синтезе аммиака, его окислении до NO, окислении NО до NO2 и взаимодействии NO2 с водой в присутствии кислорода воздуха:
N2 + 3H2  2NH3 ;
2NH3 ;
4NH3 + 5O2  4NO + 6H2O
4NO + 6H2O
2NO + O2 ® 2NO2
4NO2 + O2 + 2H2O ® 4HNO3
Азотная кислота - сильная кислота, ее соли хорошо растворимы в воде. Азотная кислота и ее соли - нитраты - являются окислителями (азот - в высшей степени окисления). Концентрированная азотная кислота не реагирует с Au и Pt, пассивирует на холоду Fe, Al, Cr, выделяет NO2 с тяжелыми металлами и N2O - с активными металлами:
Cu + 4HNO3 (конц.) ® Сu(NO3)2 + 2NO2 + 2H2O
4Ca + 10HNO3 (конц.) ® 4Сa(NO3)2 + N2O + 5H2O
Разбавленная кислота выделяет NO c тяжелыми металлами и N2 - c активными металлами, очень разбавленная кислота выделяет с активными металлами - NH3 - NH4NO3
3Cu + 8HNO3 (разб.) ® 3Сu(NO3)2 + 2NO + 4H2O
4Ca + 10HNO3 (оч.разб.) ® 4Сa(NO3)2 + NH4NO3 + 3H2O
Азотная кислота окисляет при нагревании некоторые неметаллы (S, P, C), при этом концентрированная кислота образует NO2, а разбавленная кислота - NO.
6HNO3 (конц.) + S ® 6NO2 + H2SO4 + 2H2O
5HNO3 (разб.) + 3P + 2H2O ® 5NO + 3H3PO4
Нитраты разлагаются при нагревании. Состав продуктов зависит от положения металла соли в ряду напряжений. При разложении нитратов металлов, стоящих в этом ряду левее магния, образуются нитриты и кислород, стоящих от магния до меди - оксиды металлов, оксид азота (IV) и кислород, стоящих после меди - свободные металлы, оксид азота (IV) и кислород:
2KNO3 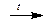 2KNO2 + O2
2KNO2 + O2
2Cu(NO3)2 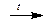 2CuO + 4NO2 + O2
2CuO + 4NO2 + O2
2AgNO3 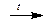 2Ag + 2NO2 + O2
2Ag + 2NO2 + O2
Соли азотной кислоты (селитры) и соли аммония являются ценными минеральными удобрениями.
Свойства фосфора и его соединений
Фосфор - составная часть растительных и животных белков. У растений фосфор сосредоточен в семенах, у животных - в нервной ткани, мышцах, скелете. Организм человека содержит около 1,5 кг фосфора: 1,4 кг - в костях, 130 г - в мышцах и 13 г в нервной ткани. В природе фосфор находится в связанном виде. Важнейшие минералы: апатит Ca5(PO4)3F и фосфорит Ca3(PO4)2. Фосфор может быть получен нагреванием смеси фосфорита, угля и песка в специальной печи:
Ca3(PO4)2 + 5C + 3SiO2 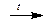 2P + 3CaSiO3 + 5CO
2P + 3CaSiO3 + 5CO
Фосфор образует несколько аллотропных модификаций: белый, красный и черный фосфор. Наиболее активен белый фосфор, молекулярная кристаллическая решетка которого построена из тетраэдрических молекул Р4. Фосфор используется при производстве фосфорорганических пестицидов (тиофоса, карбофоса, хлорофоса и др.). Красный фосфор, имеющий атомную решетку, используется в спичечном производстве.
Фосфор в степени окисления -3 образует водородное соединение фосфин PH3, аналогичное аммиаку. Эта степень окисления менее характерна для фосфора, чем для азота. Фосфин - ядовитый газ с чесночным запахом, может быть получен из фосфида цинка действием кислот или воды:
Zn3P2 + 6HCl ® 2PH3 + 3ZnCl2
Основные свойства фосфина слабее, чем у аммиака:
PH3 + HCl ® PH4Cl
Соли фосфония в водных растворах неустойчивы:
PH4+ + H2O ® PH3 + H3O+
Фосфин имеет восстановительные свойства (низшая степень окисления фосфора), горит на воздухе:
2PH3 + 4O2 ® P2O5 + 3H2O
Фосфид цинка используется в качестве зооцида для борьбы с грызунами.
Оксид фосфора(III) P2O3 (или Р4О6) образуется при окислении фосфора в недостатке кислорода и представляет собой белое кристаллическое вещество, плавящееся при 23,8оС. Этот кислотный оксид взаимодействует с водой, образуя фосфористую кислоту:
Р2О3 + 3Н2О ® Н3РО3
Фосфористая кислота в водных растворах существует в виде двух равновесных таутомерных формах:



 Н¾O O H¾O
Н¾O O H¾O



 P
P  H¾O P
H¾O P
H¾O H H¾O
Под действием щелочей равновесие сдвигается влево, при действии спиртов ROH - вправо. Поэтому фосфористая кислота является слабой двухосновной кислотой, образующей при действии щелочей, например NaOH, кислую соль NaH2PO3 и среднюю соль NaHPO3.
Трех замещенные фосфиты не известны.
Оксид фосфора(V) P2O5 (или P4O10) образуется при горении фосфора на воздухе.
4Р + 5О2 ® 2Р2О5
Твердое кристаллическое вещество Р2О5 гигроскопично и используется как водо-отнимающее средство. При взаимодействии с водой оксид фосфора(V) образует на холоду метафосфорную кислоту НРО3, имеющую полимерное строение, или при нагревании ортофосфорную кислоту Н3РО4.
P2O5 + H2O ® 2HPO3
P2O5 + 3H2O 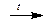 2H3PO4
2H3PO4
Осадок метафосфата серебра AgPO3 - белого цвета, осадок ортофосфата серебра Ag3PO4 - желтого цвета. В промышленности фосфорную кислоту получают действием серной кислоты на фосфорит:
Ca3(PO4)2 + 3H2SO4 ® 3CaSO4 + 2H3PO4
Ортофосфорная кислота представляет собой кристаллическое вещество (tпл = 42оС), растворимое в воде. Как трехосновная кислота средней силы диссоциирует ступенчато. Различают средние соли - фосфаты (Na3PO4) и кислые соли - гидрофосфаты (Na2HPO4) и дигидрофосфаты (NaH2PO4). Растворимы в воде фосфаты и гидрофосфаты щелочных металлов и аммония. Все дигидрофосфаты растворимы в воде.
Многие фосфаты используются в качестве удобрений: фосфоритная мука Ca3(PO4)2 и преципитат CaHPO4 (на кислых почвах), суперфосфат Ca(H2PO4)2´2CaSO4, двойной суперфосфат Ca(H2PO4)2.
Дата добавления: 2016-04-11; просмотров: 1464;
