Химия элементов IVA группы
Элементы IVA группы имеют электронную формулу ns2np2. Углерод и кремний являются неметаллами, германий, олово, свинец - металлами. Для элементов характерны степени окисления +4, +2, 0, -4 и валентность 4. В возбужденном состоянии атомы имеют конфигурацию ns1np3, в этом состоянии для них характерна s1p3-гибридизация.
Свойства углерода и его соединений
Оксид углерода(II) СО является безразличным оксидом, также, как и SiO, NO, N2O. Его можно получить:
CO2 + ® 2CO или 2С + О2 ® 2СО
СО - сильный восстановитель:
3СO + Fe2O3 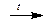 2Fe + 3CO2
2Fe + 3CO2
CO + CuO 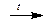 Cu + CO2
Cu + CO2
CO - угарный газ - ядовит, реагирует с гемоглобином, образую карбоксигемоглобин.
Оксид углерода(IV) CO2 - углекислый газ - взаимодействует с водой, образуя слабую, неустойчивую угольную кислоту H2CO3:
CO2 + H2O  H2CO3
H2CO3  H+ + HCO3-
H+ + HCO3-  2H+ + CO32-
2H+ + CO32-
CO2 взаимодействует с основаниями, образуя карбонаты и гидрокарбонаты:
CO2 + Ca(OH)2 ® CaCO3¯ + H2O
+ CaCO3¯ + H2O ® Ca(HCO3)2
В промышленности CO2 получают при обжиге известняка CaCO3, получая негашеную известь СаО, при температуре более 950оС:
CaCO3 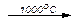 CO2 + CaO
CO2 + CaO
В лаборатории CO2 получают в аппарате Киппа, действуя на мрамор соляной кислотой:
CaCO3 + 2HCl ® CaCl2 + H2O + CO2
Образующийся при этом СО2 очищают от примесей HCl и паров воды, пропуская через раствор гидрокарбоната натрия и концентрированную серную кислоту:
HCl + NaHCO3 ® NaCl + H2O + CO2
H2O + H2SO4(конц.) ® H2SO4×H2O
СО2 не горит и не поддерживает горение, его используют для тушения пожара. CaCO3 используют для известкования сильнокислых почв.
В соединениях с металлами углерод проявляет отрицательные степени окисления: Al4+3C3-4, Ca+2C2-1 и др. Ацетиленид (“карбид”) кальция CaC2 получают при высокой температуре сплавлением оксида кальция с углем. При взаимодействии с водой CaC2 образует ацетилен.
СаО + 3С 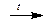 CaC2 + СО
CaC2 + СО
CaC2 + 2H2O ® Ca(OH)2 + C2H4
Cвойства кремния и его соединений
Кремний можно получить по реакции:
SiO2 + 2Mg ® Si + 2MgO
Кремний устойчив к кислотам (кроме смеси концентрированных HNO3 и HF), но растворим в щелочах:
Si + 2NaOH + H2O ® Na2SiO3 + 2H2
Оксид кремния(IV) является кислотным оксидом, но, имея полимерной строение, не растворяется в воде:
SiO2 + H2O ¹
Кремниевая кислота, очень слабая и нерастворимая в воде, может быть получена при действии кислот на ее соли - силикаты:
Na2SiO3 + 2HCl ® 2NaCl + H2SiO3¯
Кремниевая кислота при сильном нагревании разлагается на оксид кремния и воду. Силикаты натрия и калия растворимы в воде, силикаты других металлов - нерастворимы.
Свойства соединений олова и свинца
Гидроксиды олова и свинца имеют амфотерные свойства. При этом в степени окисления +2 в гидроксидах преобладают основные свойства, а в степени окисления +4 - кислотные.
SnCl2 + 2NaOH ® Sn(OH)2¯ + 2NaCl
Sn(OH)2¯ + 2HCl ® SnCl2 + 2H2O
Sn(OH)2¯ + 2NaOH ® Na2[Sn(OH)4]
SnCl4 + 4NH4OH ® H2SnO3¯ + 4NH4Cl + H2O
H2SnO3¯ + 2NaOH + H2O ® Na2[Sn(OH)6]
H2SnO3¯ + 4HCl ® SnCl4 + 3H2O
Соединения Sn2+ имеют восстановительные свойства, а соединения Pb4+ - окислительные:
SnCl2 + 2FeCl3 ® 2FeCl2 + SnCl4
PbO2 + 4HCl ® PbCl2 + Cl2 + 2H2O
Дата добавления: 2016-04-11; просмотров: 1510;
