Химия элементов IA группы.
Элементы IA группы, называемые щелочными металлами, имеют электронную формулу ns1. Они являются сильными восстановителями. Для них характерна степень окисления +1. В этой степени окисления атомы щелочных металлов устойчивы и восстанавливаются с большим трудом. В природе щелочные металлы находятся в виде соединений - солей : хлоридов, сульфатов, карбонатов, силикатов и т.д. Из-за устойчивости соединений щелочных металлов в их степени окисления +1, эти металлы можно получить лишь электролизом расплавов их солей или действием более сильных восстановителей. Например, натрий получают электролизом расплава NaCl, а калий - пропусканием паров натрия через хлорид калия при 800оС:
KCl + Na ® K + NaCl
Щелочные металлы мягкие, легко режутся ножом, на свежем срезе имеют серебристую окраску. Все они легкие и легкоплавкие металлы с хорошей электропроводностью. В парообразном состоянии атомы щелочных металлов образуют молекулы Э2, например, Na2. В кристаллическом состоянии для щелочных металлов характерны объемно-центрированные кубические решетки.
Химические свойства щелочных металлов.
Щелочные металлы весьма активны. Их активность увеличивается в ряду от лития к францию, с увеличением их радиусов и уменьшением их потенциалов ионизации. Кислород воздуха окисляет их при обычной температуре:
4Na + O2 ® 2Na2O
поэтому их хранят под слоем углеводорода (керосина).
При сгорании щелочные металлы образуют оксиды Li2O, пероксиды Na2O2, супероксиды KO2:
4Li + O2 ® 2Li2O
2Na + O2 ® 2Na2O2
K + O2 ® KO2
Щелочные металлы активно реагируют с неметаллами (галогенами, водородом, серой, фосфором и др.). Например:
2Na + Cl2 ® 2NaCl
2Na + H2 ® 2NaH
Щелочные металлы реагируют с водой, образуя соответствующие гидроксиды и водород, а поскольку реакция экзотермическая, то выделяющийся водород самовоспламеняется:
2Na + 2H2O ® 2NaOH + H2
2H2 + O2 ® 2H2O
Химические свойства соединений щелочных металлов
Гидриды щелочных металлов - солеобразные вещества - например, Na+1Н-1, взаимодействуют с водой и кислотами:
NaH + H2O ® NaOH + H2
NaH + HCl ® NaCl + H2
Оксиды щелочных металлов являются активными основными оксидами:
Na2O + H2O ® NaOH
Na2O _ CO2 ® Na2CO3
Na2O + 2HCl ® 2NaCl + H2O
Гидроксиды щелочных металлов являются растворимыми гидроксидами - щелочами. При этом их степень диссоциации увеличивается от LiOH к CsOH.
NaOH ® Na+ + OH- ( = 1)
2NaOH + CO2 ® Na2CO3 + H2O
2NaOH + H2SO4 ® Na2SO4 + 2H2O
2NaOH + ZnO 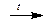 Na2ZnO2 + H2O
Na2ZnO2 + H2O
3NaOH + Al(OH)3 ® Na3[Al(OH)6]
3NaOH + FeCl3 ® Fe(OH)3¯ + 3NaCl
Пероксиды Na2O2 и супероксиды KO2 являются сильными окислителями, они разлагаются водой с образованием H2O2 и O2:
Na2O2 + 2H2O ® 2NaOH + H2O2
2KO2 + 2H2O ® 2KOH ® H2O2 + O2
Соли щелочных металлов хорошо растворяются в воде (кроме солей лития). Соли лития окрашивают пламя горелки в карминово-красный цвет, соли натрия - в желтый цвет, соли калия - в светло-фиолетовый цвет. Соли щелочных металлов со слабыми кислотами гидролизуются, создавая щелочную среду.
NaCl - поваренная соль. Человек потребляет 5-10 кг соли в год. NaNO3 - азотное удобрение. Сода Na2CO3 используется в производстве стекла, мыла, в текстильной и бумажной промышленности. Избыток солей натрия в почве - засоление почв - снижает их плодородие. Соли калия KCl, KNO3, KPO3 являются удобрениями.
Дата добавления: 2016-04-11; просмотров: 1679;
